
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація дисперсних систем
|
|
|
|
Загальні уявлення про дисперсні системи
Тема 6. Загальні уявлення про дисперсні системи. Істинні розчини. Властивості розчинів неелектролітів
ДИСПЕРСНІ СИСТЕМИ. РОЗЧИНИ. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ. ХІМІЯ В’ЯЖУЧИХ РЕЧОВИН
Системи, складові частини яких рівномірно розподілені одна в одній, називають дисперсними. Розрізняють гомогенні і гетерогенні дисперсні системи. Гомогенні дисперсні системи однофазні. Розчини і газові суміші належать до гомогенних дисперсних систем, тому що їх компоненти утворюють одну фазу.
Гетерогенні дисперсні системи багатофазні. Вони складаються з суцільної безперервної фази – дисперсійного середовища і подрібненої – дисперсної фази.
Дисперсні системи класифікують за дисперсністю, агрегатним станом дисперсної фази і дисперсійного середовища, інтенсивністю взаємодії між ними, відсутністю або утворенням структур в дисперсних системах.
Кількісною характеристикою дисперсності є ступінь дисперсності D – величина, обернена розміру (а) дисперсних частинок:
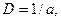
де а дорівнює або діаметру сферичних частинок, або довжині ребра кубічних частинок, або товщині плівок.
Класифікація дисперсних систем за дисперсністю представлена в таблиці 8.
Дисперсні системи третьої групи відомі під загальною назвою істинні, або молекулярні розчини. Вони можуть утворюватись самовільно, є системами термодинамічно стійкими. Дискретні одиниці в них або прості молекули, або йони.
Дисперсні системи другої групи – колоїди, або колоїдні системи. Структурною одиницею в них є або комплекс (агрегат), який складається з молекул, атомів або йонів (міцела) або макромолекула дуже великих розмірів - 10-5 – 10-7 см.
Таблиця 8
Класифікація дисперсних систем за ступенем дисперсності
| Системи | Розмір частинок, см | Ступінь дисперсності D, см-1 | Подрібненість речовин |
| Грубодис- персні | 1-10-2 10-2 – 10-5 | 1-102 102 – 105 | Макроскопічна Мікроскопічна |
| Гранично- високодис-персні | 10-5 – 10-7 | 105 – 107 | Колоїдна |
| Молекуляр-ні та йонні | 10-7 – 10-8 | 107 – 108 | Молекулярна та йонна |
Різноманітність дисперсних систем зумовлена тим, що фази, які їх утворюють, можуть бути в будь-якому з трьох агрегатних станів. Агрегатний стан фаз позначають літерами Г (газ), Р (рідина), Т (тверда речовина), вказуючи першим агрегатний стан дисперсійного середовища, а потім через тире – агрегатний стан дисперсної фази.
В залежності від агрегатного стану дисперсійного середовища і дисперсної фази розрізняють суспензії (зависі), емульсії, аерозолі, піни (див. табл. 9).
Суспензії – це грубодисперсні системи, зависі твердих частинок у рідинах (Р1 – Т2). У вигляді суспензій застосовують будівельні матеріали (цементи, глини, тощо), лаки і фарби, засоби боротьби з шкідниками сільськогосподарських культур.
Емульсіями називають дисперсні системи, що складаються з двох взаємно нерозчинних рідин, одна з яких розподілена в іншій у вигляді дуже маленьких крапельок (Р1 – Р2). Прикладами емульсій можуть слугувати бензин у воді, олія у воді, молоко.
Дисперсні системи з газоподібним дисперсійним середовищем називають аерозолями. Тумани – це аерозолі з рідкою дисперсною фазою (Г1 – Р2), а пил, дим – аерозолі з твердою дисперсною фазою (Г1 – Т2).
Таблиця 9
Класифікація дисперсних систем за агрегатним
станом дисперсійного середовища і дисперсної фази
| Агрегатний стан дисперсійного середовища | Агрегатний стан дисперсної фази | ||
| Газовий | Рідкий | Твердий | |
| Газовий | Гомогенна система | Туман Г1-Р2 (аерозоль) | Дим, пил Г1-Т2 (аерозоль) |
| Рідкий | Піна Р1-Г2 | Емульсія Р1-Р2 | Суспензія Р1-Т2 |
| Твердий | Тверда піна Т1-Г2 | Рідкі включення в твердих тілах Т1-Р2 | Тверді включення в твердих тілах Т1-Т2 |
Піни – це дисперсні системи, що складаються з комірок, заповнених газом і відділених одна від одної рідкими або твердими плівками дуже малої товщини (Р1 – Г2, Т1 – Г2).
У твердому дисперсійному середовищі також можуть бути дисперговані рідини або тверді речовини. До системи Т1 – Г2 (тверді піни) належать пінопласти, пінобетон, пемза, шлак. Прикладом системи Т1 – Р2 є перли, що являють собою кальцій карбонат, у якому диспергована вода. До дисперсних систем типу Т1 – Т2 належать будівельні матеріали (наприклад, бетон), сплави, кольорове скло, ряд мінералів.
Дисперсні системи можуть бути вільнодисперсними (аерозолі, розбавлені емульсії і суспензії) і зв’язанодисперсними – гелями. Зв’язанодисперсні системи виникають при контакті частинок дисперсної фази, який призводить до утворення структури у вигляді каркасу або сітки. Порошки, концентровані емульсії і суспензії (пасти), піни, грунт – приклади зв’язанодисперсних систем.
Характеристика розчинів. Процес розчинення
Системи, в яких одна речовина рівномірно розподілена у вигляді частинок різного розміру в іншій, називаються дисперсними.
Якщо розмір частинок меншій за 1 нм (1 нм = 10-9 м), то така система називається істинним розчином. Це однорідна (гомогенна) однофазна система, в якій подрібнена речовина знаходиться у вигляді молекул або йонів. Інше формулювання: розчин – це гомогенна система, що складається з двох чи більшого числа компонентів, відносні кількості яких можуть змінюватись в широких межах.
Розчини отримують з розчинної речовини і розчинника.
В природі і техніці розчини мають дуже велике значення. Всі природні води, а також найважливіші фізіологічні рідини – кров, лімфа тощо є розчинами. Багато хімічних реакцій відбувається в розчинах. Найбільше значення мають розчини з розчинником рідиною, найчастіше водою.
Розчини займають проміжне положення між механічними сумішами і хімічними сполуками.
Однорідність розчинів і виділення теплоти при розчиненні деяких речовин наближає розчини до хімічних сполук. Склад же розчинів може змінюватись в широких межах. Непостійність складу відрізняє розчини від хімічних сполук і наближає їх до механічних сумішей.
При розчиненні кристала в рідині відділення молекул або йонів від поверхні твердої речовини відбувається за рахунок їх власного коливального руху і притягання з боку молекул розчинника. Молекули або йони які перейшли в розчин, стикаючись з поверхнею ще нерозчиненої речовини, знову притягаються до неї і входять до складу її кристалів. Через деякий час встановлюється динамічна рівновага, при якій в одиницю часу стільки ж молекул (йонів) розчиняється, скільки виділяється з розчину.
Розчин, який перебуває в рівновазі з розчиненою речовиною, називають насиченим.
Ненасиченим називають розчин, в якому при даних умовах ще може розчинитись деяка кількість взятої речовини.
Перенасиченим називають розчин, який містить розчиненої речовини більше, ніж це відповідає розчинності цієї речовини при даній температурі. Дуже легко утворюють перенасичені розчини глауберова сіль Na2SO4 . 10H2O, бура Na2B4O7 . 10H2O, натрій ацетат - вода (1/3) CH3COONa . 3H2O.
Для одержання перенасиченого розчину необхідно спочатку одержати насичений розчин при температурі 90-1000, а потім його обережно охолодити до кімнатної температури.
Кристалізація надлишку розчиненої речовини може відбуватись при внесенні кристалика речовини в розчин або від струсу розчину.
Перенасичені розчини були відкриті і вивчені в 1794 р. російським академіком Т.Е.Ловіцем. Можливість існування таких розчинів пояснюється трудністю початкового виникнення центрів кристалізації.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 16805; Нарушение авторских прав?; Мы поможем в написании вашей работы!