
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порушення рівноваги внаслідок зміни температури
|
|
|
|
Порушення рівноваги внаслідок зміни тиску
Розглянемо цю ж реакцію між воднем і азотом:
 L
L 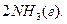
Тиск газу залежить від кількості молекул в даному об'ємі. Одна молекула азоту і три молекули водню (всього 4 молекули) перетворюються в дві молекули амоніаку. Тиск знижується при перебігу прямої реакції і збільшується - при перебігу зворотної. При збільшенні тиску рівновага зсувається в бік зменшення числа молекул газів, тобто в бік зниження тиску; при зменшенні тиску рівновага зсувається в бік зростання числа молекул газів, тобто в бік збільшення тиску.
Якщо реакція відбувається без зміни числа молекул газів, рівновага не порушується при зміні тиску. Наприклад, при перебігу реакції:
 L
L 
число молекул газів не змінюється, тиск не спричиняє зміщення рівноваги.
При підвищенні температури рівновага зміщується в напрямку ендотермічної реакції, а при пониженні - в напрямку екзотермічної реакції.
Так, синтез амоніаку – екзотермічна реакція:
 L
L  ;
; 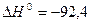 кДж.
кДж.
Тому при підвищенні температури рівновага зміщується вліво – в бік розкладання амоніаку, оскільки цей процес ендотермічний.
Навпаки, термічна дисоціація кальцій карбонату – ендотермічний процес:
 L
L  ;
; 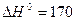 кДж.
кДж.
Тому при підвищенні температури рівновага зміщується вправо – в бік утворення СаО і СО2.
Запитання для самоконтролю
1. Що є об’єктом вивчення в термодинаміці?
2. Що називають системою? На які типи поділяють системи?
3. Які величини характеризують термодинамічні системи?
4. Що являє собою функція стану? Від чого вона залежить?
5. З яких величин складається внутрішня енергія системи?
6. Яке формулювання першого закону термодинаміки? Який його математичний вираз?
7. Яка функція включає внутрішню енергію та роботу?
8. Які реакції називають екзотермічними, ендотермічними?
9. Що називають тепловим ефектом реакції?
10. Які умови називають стандартними?
11. Який стан речовин називають стандартним?
12. Що називають ентальпією утворення речовини?
13. На якому законі та його наслідку грунтуються термохімічні розрахунки?
14. Яка функція характеризує ступінь невпорядкованості в системі?
15. Як формулюється другий закон термодинаміки?
16. Як називають вільну енергію системи при сталому тиску і температурі?
17. Які процеси в природі відбуваються самовільно?
18. Яке існує співвідношення між енергією Гіббса, ентальпією та ентропією?
19. Як визначити напрямок перебігу хімічної реакції?
20. Як називається розділ хімії, який вивчає швидкість перебігу хімічних реакцій?
21. Яка система називається гомогенною, яка – гетерогенною?
22. Чим визначається швидкість реакції: а) в гомогенній системі; б) в гетерогенній системі?
23. Які чинники впливають на швидкість хімічної реакції?
24. Яка існує залежність між швидкістю реакцій і концентраціями реагуючих речовин в гомогенній та в гетерогенній системах? Як формулюється закон діючих мас?
25. Як залежить швидкість реакції від температури? Як формулюється правило Вант-Гоффа?
26. Які реакції називають: а) необоротними; б) оборотними?
27. Який стан системи називають рівноважним? Як можна порушити рівновагу в системі?
28. Який принцип визначає напрямок зсуву рівноваги?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!