
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи вираження вмісту розчиненої речовини в розчині
|
|
|
|
Вміст розчиненої речовини в розчині може бути виражений безрозмірними величинами – частками, або відсотками і розмір-ними - концентраціями.
В хімічній практиці найбільш поширені такі способи вираження складу розчинів:
1. Масова частка - відношення (найчастіше у відсотках) маси розчиненої речовини до маси розчину

Масова частка, виражена у відсотках, показує, скільки грамів речовини міститься в 100 г розчину.
2. Молярна концентрація – відношення кількості розчиненої речовини до об’єму розчину:
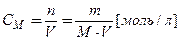 .
.
Якщо СМ = 1 моль/л, розчин називають одномолярним, якщо в 1 л розчину міститься 0,1 моль речовини, то його називають дерімо-лярним, 0,01 моль – сантімолярним, 0,001 моль – мілімолярним. Приклади запису молярної концентрації: СМ(Н3РО4) = 0,5 моль/л, або СМ(Н3РО4) = 0,5 М.
3. Молярна концентрація еквівалента (нормальна концентрація) – відношення кількості речовини еквівалента розчиненої речовини до об’єму розчину:
 [моль/л].
[моль/л].
Приклади запису: СН.(Н2SO4) = 1 моль/л або СН.(Н2SO4) = 1 н.
Речовини реагують в кількостях, пропорційних їхнім еквівалентам, тому об’єми розчинів реагуючих речовин обернено пропорційні їхнім нормальним концентраціям:
 або
або 
кількість кількість
речовини речовини
еквівалента 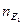 еквівалента
еквівалента 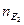
Це співвідношення використовують для обчислень в об’ємному аналізі.
4. Моляльна концентрація – відношення кількості розчине-ної речовини до маси розчинника:
 [моль/л],
[моль/л],
де mP - маса розчиненої речовини, MP - молярна маса розчиненої речовини, mР-КА - маса розчинника (г).
5. Мольна частка – відношення кількості розчиненої речови-ни або розчинника до кількості всіх речовин, які складають розчин.
Мольна частка розчиненої речовини (N2) і розчинника (N1) відповідно дорівнюють:
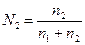 ,
, 
де n1 - кількість речовини розчинника, n2 - кількість розчиненої речовини.
6. Титр розчину Т – маса речовини, що міститься в одному мілілітрі (кубічному сантиметрі) розчину [г/мл]. Наприклад, Т(Н2SO4) = 0,1 г/мл. Це означає, що в 1 мл розчину міститься 0,1 г Н2SO4.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 4138; Нарушение авторских прав?; Мы поможем в написании вашей работы!