
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 1.3. Будова речовин
|
|
|
|
План
Тема 1.2. Будова атома
1. Сучасні уявлення про будову атома. *
- Характеристика квантових чисел. **
- Розподіл електронів по рівнях і підрівнях. **
1. Довго в науці панувала думка, що атоми неподільні, тобто не містять простіших складових частин. Вважалося також, що атоми незмінні: атом певного елемента ні за яких умов не може перетворитися в атом будь-якого іншого елемента. Проте наприкінці ХІХст. було встановлено ряд фактів, які свідчать про складну будову атомів і про можливість взаємоперетворень їх.
Резерфорд у 1911р. запропонував схему будови атома, згідно якої він містив позитивно заряджене важке ядро, оточене електронами. Проте модель Резерфорда у деяких відношеннях суперечила твердо встановленим фактам:
- не пояснювала стійкості атома (за законами електродинаміки електрон, обертаючись навколо ядра, повинен в результаті втрати енергії на випромінювання «впасти» на ядро і атом припинить своє існування)
- при наближенні до ядра довжини хвиль, що випромінюються електроном, повинні безперервно змінюватися, утворюючи суцільний спектр. А спектр є лінійчатим.
Істотний крок у розвитку уявлень про будову атома зробив у 1913р. Нільс Бор, який запропонував теорію, що об’єднує ядерну модель атома з квантовою теорією світла.
Основні положення своєї теорії Бор сформулював у вигляді таких постулатів:
- Електрон може обертатися навколо ядра не по будь-яких, а тільки по деяких певних колових орбітах (стаціонарних). рухаючись по стаціонарній орбіті, електрон не випромінює електромагнітну енергію.
- При переході з однієї орбіти на іншу електрон поглинає або випромінює квант енергії.
Проте залишалось незрозумілим: де перебуває електрон у процесі переходу з однієї орбіти на іншу? Зомерфельд вдосконалив теорію Бора. Він припустив, що в атомі можуть бути не тільки кругові, а й еліптичні орбіти електронів. Недоліки теорії Бора-Зомерфельда:
- не пояснює всі деталі спектральних характеристик атомів
- не дає можливості кількісно розрахувати хімічний зв'язок.
У 1924р. де Бройль припустив, що корпускулярно-хвильова двоїстість властива електронам. Тому електрон повинен мати хвильові властивості, і для нього справджується рівняння де Бройля. Для електрона з масою і швидкістю можна написати:
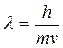
Корпускулярні властивості електрона виявляються у його здатності проявляти свою дію тільки як цілого. Хвильові властивості виявляються в особливостях його руху, дифракції і інтерференції електронів.
2. Існує система квантових характеристик електрона (квантові числа), яка визначає стан електрона в атомі.
Характеристика квантових чисел
| Головне | n | Визначає можливі енергетичні стани електрона в атомі. Чим більше n, тим більший розмір електронної хмаринки і більша енергія електрона. Набуває позитивні цілочисельні значення – 1, 2, 3, 4…, які відповідають енергетичному рівню електрона. |
| Орбітальне | l | Визначає форму електронної орбіталі. Може приймати значення від 0 до (n-1). Таким чином для: 1) n =1 - підрівень l = 0(s-стан) – сферична форма орбіта лі; 2) n =2 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; 3) n =3 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма 4) n =4 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма; підрівень l = 3(f-стан) 5) n =5- підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма; підрівень l = 3(f-стан) підрівень l = 4(g- стан) |
| Магнітне | m | Визначає орієнтацію орбіта лі в просторі. Набуває цілочисленних значень від +l до –l, включаючи 0. |
| Спінове | s | Визначає стан електрона. Крім орбітального момента кількосиі руху, електрон володіє власним моментом кількості руху в результаті руху навколо своєї осі. Цей рух має назву «спін». Може приймати два значення +1/2 і -1/2 або просто + і -. |
Приклад: для атому Гідрогену характерний набір квантових чисел: n=1; l=0; m=0; s=+1/2 або -1/2.
Електронні стани, які відповідають певним значенням n, l, m позначають коміркою. Таких стани два, і вони відрізняються лише s. Комірка являється символічним зображенням певної орбіталі.
3. Заповнення електронних оболонок атомів електронами головним чином визначається принципом Паулі і правилом Гунда (Хунда).
Принцип Паулі:
В атомі не може бути двох електронів в станах, які характеризуються чотирма однаковими квантовими числами.
Цей принцип дає можливість визначити число електронів на енергетичному рівні і підрівні.
Правило Гунда (заповнення орбіталей підрівня):
В межах підрівня електрони заповнюють максимальне число орбіталей.
або
Сумарний спін електронів в даному підрівні повинен бути максимальним.
Послідовність заповнення атомних орбіталей залежно від значень головного і орбітального квантових чисел дослідив Клечковський, який встановив, що енергія електрона зростає із збільшенням суми цих двох квантових чисел.
Правила Клечковського:
1) При збільшенні заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей з меншим значенням суми головного і орбітального квантових чисел до орбіталей з більшим значенням цієї суми.
Електронна будова атомів калію і кальцію відповідає цьому правилу. Для 3d-орбіталей (n=3, l=2) сума дорівнює 5, а для 4s-орбіталі (n=4, l=0) дорівнює 4. Раніше заповнюється 4s-підрівень.
2) При однакових значеннях суми (n+l) заповнення орбіталей відбувається послідовно у напрямі зростання значення головного квантового числа n.
Контрольні запитання:
- Постулати Бора. Недоліки теорії Бора.
- Запишіть квантові числа для останнього електрона атома Карбону.
- Сформулюйте правила Клечковського.
- Яка орбіталь буде заповнюватися першою 5s або 4f? Відповідь обґрунтуйте розрахунками.
- Складіть електронні та графічні формули атомів алюмінію, кадмію, вольфраму.
Література:
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. ІІІ, §§ 20-32 с. 57-99.
2. Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 2, §§ 9-12, 14, с. 16-23.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!