
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчин, його склад. 2 страница
|
|
|
|
3. Розрахунки в термохімії ґрунтуються на законі Гесса.
Закон Гесса:
Тепловий ефект реакції залежить тільки від початкового і кінцевого стану речовин і не залежить від проміжних стадій.
1) 2NaOH(водн) + H2SO4(водн) → Na2SO4(водн) + 2H2O + 131,4 кДж
2) NaOH(водн) + H2SO4(водн) → NaHSO4(водн) + H2O + 61,7 кДж
NaHSO4(водн) + NaOH(водн) → Na2SO4(водн) + H2O + 69,7 кДж
Правило з закону Гесса: тепловий ефект хімічної реакції дорівнює сумі теплот утворення кінцевих речовин з відніманням суми теплот утворення вихідних речовин (з врахуванням коефіцієнтів в рівнянні реакції)
Контрольні запитання:
- Що називається тепловим ефектом реакції?
- Класифікація реакцій за тепловим ефектом.
- Закон Гесса.
- При взаємодії 9,18 л хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції. Розрахуйте значення теплоти утворення хлороводню.
- Теплота утворення аміаку становить -46 кДж/моль. Скільки теплоти виділиться при взаємодії 80 л водню (н.у.) з надлишком азоту?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. VІ, §§ 54-56, с. 166-170.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 2, §§ 9-12, 14, с. 16-23.
Тема 2.4. Хімічна кінетика
- Кінетика. Поняття про швидкість реакції.
- Фактори, які впливають на швидкість реакції
2.1. Концентрація реагуючих речовин.**
2.2. Температура та природа реагуючих речовин.*
2.3. Наявність каталізаторів.*
1. З курсу хімії ви вже знаєте, що всі реакції відбуваються з різними швидкостями. Деякі з них повністю закінчуються за малі частки секунди, інші тривають хвилини, години, дні; відомі реакції, що потребують для свого перебігу кілька років, десятиріч і ще більших відрізків часу. Крім того, та сама реакція може в одних умовах, наприклад, при підвищених умовах відбуватися швидко, а в інших, наприклад, під час охолодження, − повільно.
Знання швидкостей хімічних реакцій має дуже велике наукове і практичне значення. Наприклад, у хімічній промисловості при виготовленні тієї чи іншої речовини від швидкості реакції залежать розміри і продуктивність апаратури, кількість виготовленого продукту.
Розділ хімії, що вивчає швидкість хімічних реакцій, називається хімічною кінетикою.
Швидкістю гомогенної реакції називається: 1) кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу в одиниці об’єму системи
2) Швидкістю реакції в гомогенній системі називається зміна концентрації будь-якої з речовин, що вступають у реакцію або утворюються під час реакції, що відбувається за одиницю часу.
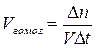 або
або 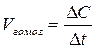 ,
,
де ΔС – зміна концентрації; Δn – зміна кількості речовини; Δt – зміна часу; V – об’єм системи.
Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу на одиниці поверхні фази.
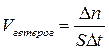 , де S – площа поверхні фази, на якій відбувається реакція
, де S – площа поверхні фази, на якій відбувається реакція
2. Фактори, що впливають на швидкість реакції:
· Природа реагуючих речовин;
· Концентрація речовин;
· Температура;
· Наявність у системі каталізаторів
2.1. Необхідною умовою, щоб між частинками вихідних речовин відбулася хімічна взаємодія, є їхнє зіткнення одна з одною. Тому швидкість реакції пропорційна числу зіткнень, яких зазнають молекули реагуючих речовин.
Число зіткнень тим більше, чим вища концентрація кожної з вихідних речовин, або те саме, чим більший добуток концентрацій реагуючих речовин. Так, швидкість реакції А + В → С пропорційна добутку концентрації речовини А на концентрацію речовини В. Позначаючи концентрації речовин А і В відповідно через [А] і [В], можна написати:
υ = k[А][В], де
k – коефіцієнт пропорційності, що називається константою швидкості реакції.
Аналогічно, для реакції 2А + В → С можна написати υ = k[А][А][В] = k[А]2[В].
Викладені міркування підтверджуються законом діючих мас (закон Гульдберга-Вааге): При сталій температурі швидкість хімічної реакції пропорційна добуткові концентрацій реагуючих речовин, причому кожна концентрація входить у добуток в степені, що дорівнює коефіцієнту, який стоїть перед формулою речовини в рівнянні реакції.
Щоб дістати рівняння закону діючих мас, напишемо рівняння хімічної реакції в загальному вигляді: aA + bB + …→ …
Тоді за законом діючих мас можна записати у формі:
υ = k[А]a[В]b…
У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації тільки тих речовин, які перебувають в газовій фазі або в розчині. Концентрація речовини, що перебуває в твердій фазі, звичайно є сталою величиною і тому входить у константу швидкості.
Величина константи швидкості залежить від природи реагуючих речовин, температури і наявності каталізаторів, але не залежить від концентрацій речовин.
2.2. Якщо скористатися результатами підрахунків, то виявиться, що число зіткнень між молекулами речовин за звичайних умов таке велике, що всі реакції мають відбуватися практично миттєво. Але не всі реакції закінчуються швидко. Цю суперечність можна пояснити, припустивши, що не всяке зіткнення речовин приводить до утворення продукту реакції. Щоб сталася реакція, треба спочатку розірвати або ослабити зв’язки між атомами в молекулах вихідних речовин, а на це потрібно затратити певну енергію.
З підвищенням температури число активних молекул зростає. Звідси виходить, що і швидкість хімічної реакції має збільшуватися з підвищенням температури.
Зростання швидкості реакції із зростанням температури прийнято характеризувати температурним коефіцієнтом швидкості реакції – числом, що показує, у скільки разів зростає швидкість певної реакції при підвищенні температури системи на 10 градусів. Температурний коефіцієнт різних реакцій різний.
Правилом Вант-Гоффа:
При підвищенні температури на кожні 10°С швидкість реакції зростає в 2-4 рази.
Математичний вираз правила Вант-Гоффа:
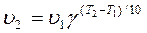
γ- температурний коефіцієнт; Т1 і Т2 – початкова і кінцева температури
2.3. Речовини, що не витрачаються в результаті проходження реакції, але не впливають на її швидкість, називаються каталізаторами. Явище зміни швидкості реакції під дією каталізаторів називається каталізом.
У більшості випадків дія каталізаторів пояснюється тим, що він знижує енергію активації реакції. При наявності каталізатора реакція проходить через інші проміжні стадії, при чому ці стадії енергетично більш доступні.
Контрольні запитання:
- Що називається швидкість реакції?
- Назвіть фактори, які впливають на швидкість хімічної реакції.
- У скільки разів збільшиться швидкість реакції при підвищенні температури з 20ºС до 40ºС, якщо температурний коефіцієнт дорівнює 3?
- При охолодженні реакційної суміші з 80ºС до 50ºС швидкість хімічної реакції зменшилась у 27 разів. Визначте температурний коефіцієнт реакції.
- У скільки разів збільшиться швидкість реакції СО(г) + Cl2(г) → COCl2(г), якщо концентрації вихідних речовин збільшити в 2 рази?
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. VІ, §§ 57-61, с. 170-181.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 4, §§ 30-32, с. 40-43.
Тема 2.5. Хімічна рівновага
- Поняття про ланцюгові реакції.
- Стан хімічної рівноваги.*
3. Зміщення хімічної рівноваги. Принцип Ле Шательє.**
1. Досі ми з вами розглядали хімічні реакції, що відбуваються порівняно просто. У таких реакціях кожний елементарний акт взаємодії – кожне зіткнення між активними молекулами реагуючих речовин – відбувається незалежно від результатів попередніх елементарних актів. Утворення макроскопічних кількостей продукту реакції є тут результатом великої кількості таких актів, що не залежать один від одного.
Проте існує велика група реакцій, що відбуваються складніше. У цих реакціях можливість перебігу кожного елементарного акту спряжена з успішним проходженням попереднього акту і, в свою чергу, зумовлює можливість наступного. Тут утворення макроскопічних кількостей продуктів реакції є результатом ланцюга елементарних актів взаємодії. Такі реакції називаються ланцюговими.
Ланцюгові реакції відбуваються за участю активних центрів – атомів, йонів або радикалів, що мають неспарені електрони і виявляють внаслідок цього дуже високу активність. Роль активних центрів можуть відігравати, наприклад, атоми і групи атомів.
При актах взаємодії активних центрів з молекулами вихідних речовин утворюються молекули продукту реакції, а також нові активні частинки – нові активні центри, здатні до акту взаємодії.
Прости прикладом ланцюгової реакції може бути реакція синтезу хлороводню: H2 + Cl2 → 2HCl
Ця реакція спричинюється дією світла. Поглинання кванта променистої енергії молекулою хлору спричинює її збудження – появу в ній енергетичних коливань атомів. Якщо енергія коливань перевищує енергію зв’язків між атомами, то молекула розпадається. Це можна виразити рівнянням:
Cl2 + hν → 2Cl∙
Cl∙ + H2 → HCl + H∙
H∙ + Cl2 → HCl + Cl∙
В розглянутому випадку число ланок може досягати 100000. Закінчується ланцюг при зіткненні вільного атома з стінкою посудини, у якій відбувається реакція. Ланцюг може закінчитися також при такому зіткненні двох активних частинок і однієї неактивної, в результаті якого активні частинки сполучаються в молекулу, а енергія, що виділяється, виноситься неактивною частинкою.
2. Коли швидкості прямої і зворотної реакцій стають однаковими, настає хімічна рівновага. Хімічну рівновагу називають динамічною. Цим підкреслюється, що при рівновазі відбуваються пряма і зворотна реакції, але їхні швидкості однакові, внаслідок чого змін у системі не помітно.
Кількісною характеристикою хімічної рівноваги є величина, що називається константою хімічної рівноваги. Константа хімічної рівноваги – відношення констант швидкості прямої і зворотної реакцій.
Нехай в системі протікає обернена хімічна реакція між газоподібними речовинами N і M і утворюються газоподібні речовини D і G.
n N + m M ↔ d D + g G.
Константа хімічної рівноваги в цьому випадку може бути знайдена як:
КР = 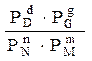 .
.
При сталій температурі К оборотної реакції є сталою величиною, що показує те співвідношення між концентраціями продуктів реакції і вихідних речовин, яке установлюється при рівновазі.
Величина константи рівноваги залежить від природи реагуючих речовин і температури.
2.3. Досягнувши стану хімічної рівноваги, система буде знаходитися в ньому до тих пір, доки не будуть змінені зовнішні умови. Це приведе до зміни параметрів системи, тобто до зсуву хімічної рівноваги в бік однієї з реакцій. Для якісного визначення напрямку зміщення рівноваги в хімічній реакції служить принцип Ле Шательє:
Якщо на систему, що знаходиться в рівновазі, подіяти ззовні, тобто змінити умови, при яких система знаходилась в рівновазі, то в системі з більшою швидкістю почнуть протікати процеси, що зменшують зовнішній вплив.
На стан хімічної рівноваги найбільше впливають концентрація, тиск і температура.
1) Збільшення концентрації вихідних речовин N і M приводить до збільшення швидкості прямої реакції. Збільшення концентрації продуктів зміщує рівновагу в бік протікання оборотної реакції.
2) тиск (для газів)
N2 + 3 H2 ↔ 2 NH3.
В результаті протікання прямої реакції число молекул газів зменшився з 4 моль до 2 моль.
При підвищенні загального тиску рівновага зміщується в бік реакції, яка приводить до зменшення числа молекул газоподібних речовин, а при зменшенні тиску – в бік реакції, в якій збільшується число молекул газів.
3) температура
При підвищенні температури рівновага завжди зміщується в бік ендотермічної реакції. а при зниженні – в бік екзотермічної реакції.
Контрольні запитання:
- Коли настає стан хімічної рівноваги?
- Сформулюйте принцип Ле Шательє.
- Вкажіть фактори, які впливають на зміщення хімічної рівноваги.
- Як зміниться стан рівноваги в наведених реакціях при підвищенні тиску:
а) H2(г) + Cl2(г) ↔ 2HCl(г)
б) PCl3(г) + Cl2(г) ↔ PCl5(г)
в) 2CO(г) + O2(г) ↔ 2CO2(г)
- Як зміниться стан рівноваги в наведених реакціях при збільшенні температури:
а) 2SO2(г) + O2(г) ↔ 2SO3(г); ∆H<0
б) N2(г) + O2(г) ↔ 2NO(г); ∆H>0
в) CO2(г) + C ↔ 2CO (г); ∆H>0
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. VІ, §§ 62-64, с. 181-190.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 4, §§ 33-35, с. 44-45.
РОЗДІЛ 3. ДИСПЕРСНІ СИСТЕМИ. РОЗЧИНИ. КОМПЛЕКСНІ РЕЧОВИНИ.
Тема 3.1. Дисперсні системи
- Дисперсні системи. Склад дисперсних систем.
- Класифікація дисперсних систем
2.1. Класифікація за ступенем дисперсності.*
2.2. Класифікація за агрегатним станом.**
2.3. Класифікація за взаємодією між часточками дисперсної фази.*
3. Поняття про колоїдні розчини.*
1. Системи, в яких одна речовина розподілена в середовищі іншої у вигляді дуже дрібних частинок, називаються дисперсними системами. Вони складаються з роздроблених часточок того чи іншого розміру і форми (дисперсна фаза), і оточуючої їх речовини (дисперсійне середовище). Отже всі дисперсні системи є гетерогенними.
Обов’язковою умовою існування дисперсних систем є взаємна нерозчинність диспергованої речовини і дисперсійного середовища. Наприклад, не можна дістати колоїдні розчини цукру або солі у воді, але їх можна мати у гасі чи бензолі, у яких ці речовини не розчиняються.
2. Дисперсні системи класифікують за дисперсністю, агрегатним станом дисперсної фази і дисперсійного середовища, інтенсивністю взаємодії між ними, відсутністю або утворенням структур у дисперсних системах.
2.1. Кількісною характеристикою дисперсності речовини є ступінь дисперсності (D) – величина, обернена поперечнику а дисперсних часток:
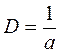 ,
,
де а дорівнює діаметру сферичних чи волокнистих, або довжині ребра кубічних часточок чи товщині плівок.
| Системи | Роздробленість речовини | Поперечник часточок, см | Ступінь дисперсності, см-1 | Число атомів в одній часточці |
| Грубодисперсні | Макроскопічна Мікроскопічна | 1-10-2 10-2-10-5 | 1-102 102-105 | >1018 >109 |
| Гранично-високодисперсні | Колоїдна | 10-5 - 10-7 | 105 - 107 | 109- 103 |
| Молекулярні або йонні | Молекулярна та йонна | 10-7 – 10-8 | >107 | >103 |
2.2. Записуючи схематично агрегатний стан дисперсних систем, першим вказують агрегатний стан дисперсійного середовища за допомогою букв Г (газ), Р (рідина),або Т (твердий), потім ставлять тире і записують агрегатний стан дисперсної фази.
Табл. Класифікація дисперсних систем за агрегатним станом
| № | Агрегатний стан дисперсійного середовища | Агрегатний стан дисперсної фази | Схема дисперсної системи | Тип дисперсної системи | Приклади |
| газ | рідина | Г1 – Р2 | Туман – це аерозоль з рідкою дисперсною фазою | ||
| газ | твердий | Г1 – Т2 | Пил і дим – це аерозоль з твердою дисперсною фазою; Пил утворюється в результаті диспергування речовин; а дим – в результаті конденсації летких речовин | ||
| рідина | газ | Р1 – Г2 | Піна – дисперсія газу в рідині | ||
| рідина | рідина | Р1 – Р2 | Емульсія – дисперсні системи, у яких одна рідина роздроблена в іншій рідині, що її не розчиняє | рослинна олія і вода; бензин і вода | |
| рідина | твердий | Р1 – Т2 | Суспензії (зависі) – низько дисперсні системи твердих часточок у рідинах Колоїдні розчини (золі) – гранично-високодисперсні системи твердих часточок у рідинах | суміш крейди з водою | |
| твердий | газ | Т1 – Г2 | Тверді піни – дисперсія газу в твердому тілі | Пінопласти, пінобетон, пемза, шлак, метали з включенням газів; хлібобулочні вироби | |
| твердий | рідина | Т1 – Р2 | Натуральні перли, що являють собою карбонат кальцію, у якому колоїдно диспергована вода | ||
| твердий | твердий | Т1 – Т2 | Бетон, деякі сплави, кольорове скло (диспергування в силікатному склі домішок металів або їхніх оксидів. Що надають склу забарвлення), емалі (різновидності силікатного скла з включеннями пігментів SnO2, TiO2, ZrO2), ряд мінералів, коштовних каменів (рубін –Cr2O3 диспергований в Al2O3) |
2.3. Дисперсні системи можуть бути вільнодисперсними і зв’язнодисперсними. До вільно дисперсних систем належать аерозолі, лізолі, розбавлені суспензії та емульсії. Вони текучі. У цих системах часточки дисперсної фази не мають контактів, беруть участь у безладному тепловому русі. Вільно рухаються під дією сили тяжіння.
Зв’язнодисперсні системи – твердоподібні; вони виникають при контакті часточок дисперсної фази, що приводить до утворення структури у вигляді каркасу або сітки. Така структура обмежує текучість дисперсної системи і надає їй здатності зберігати форму. Подібні структуровані системи називають гелями. Приклади: порошки, концентровані емульсії і суспензії (пасти), піни.
Дисперсні системи принципово термодинамічно нестійкі, що приводить до руйнування систем: тумани випадають дощем, емульсії розшаровуються, колоїдні розчини коагулюють.
3. Колоїдні часточки можуть мати різну внутрішню структуру, що істотно позначається на способах утворення колоїдних розчинів і на їхніх властивостях. Існують три типи внутрішньої структури первинних часточок колоїдних розчинів.
І тип – суспензоїди (необоротні колоїди, ліофобні колоїди). Так називають колоїдні розчини металів, їхніх оксидів, гідроксидів, сульфідів та інших солей. Суспезоїди – типові гетерогенні високодисперсні системи, властивості яких визначаються дуже сильно розвинутою міжфазовою поверхнею. Від суспензій вони відрізняються вищою дисперсністю. Як і суспензії, не можуть тривалий час існувати, коли немає стабілізатора дисперсності. Необоротними їх називають тому, що осади, які лишаються при випаровуванні таких колоїдних розчинів, не утворюють знову золю в разі контакту з дисперсійним середовищем.
Ліофобні золі можна добути двома способами: диспергуванням, тобто подрібненням великих тіл, і конденсацією молекулярно- або іонно розчинених речовин.
ІІ тип – асоціативні або міцелярні колоїди (напівколоїди)
Міцели – скупчення правильно розміщених молекул, що утримуються переважно дисперсійними силами.
Утворення міцел є характерним для водних розчинів миючих речовин і деяких органічних барвників з великими молекулами; в інших середовищах, наприклад в етиловому спирті. Ці речовини розчиняються з утворенням молекулярних розчинів.
ІІІ тип – молекулярні колоїди (оборотні або ліофільні колоїди). До них належать природні і синтетичні ВМС з молекулярною масою від 10000 до кількох мільйонів. Речовини цього типу назвали оборотними колоїдами, тому що після випаровування їх розчинів і добавляння нової порції розчинника сухий залишок знову переходить у розчин.
Контрольні запитання:
- Що називається дисперсними системами?
- Склад дисперсних систем.
- Класифікація дисперсних систем.
- Що називається ступенем диспергування?
- Типи колоїдних розчинів.
Література:
- Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. Х, §§ 105-107, с. 305-316.
- Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 5, §48, с. 57-58.
Тема 3.2. Розчини і розчинність
- Концентрація розчинів.**
- Розчинність.*
- Осмос та осмотичний тиск.**
- Тиск пари розчинів. Закон Рауля.**
1. Більшість реакцій, які відбуваються в хімії протікають в розчинах. Розчини мають важливе значення в житті і практичній діяльності людини. Так, процеси засвоєння їжі людиною і тваринами пов’язані з переведенням харчових речовин у розчин. Розчинами є всі найважливіші фізіологічні рідини (кров, лімфа). Виробництва, в основі яких лежать хімічні процеси, звичайно пов’язані з використанням розчинів.
Розчин – тверда або рідка гомогенна система, що складається з двох чи більшої кількості компонентів (складових частин), відносні кількості яких можуть змінюватися в широких межах. Найважливіший вид розчину – рідкі розчини.
Будь-який розчин складається з розчинених речовин і розчинника, тобто середовища, в якому ці речовини рівномірно розподілені у вигляді молекул або йонів. Звичайно розчинником вважають той компонент, який у чистому вигляді існує в такому самому агрегатному стані, що й добутий розчин. Коли ж обидва компонента до розчинення перебували в однаковому агрегатному стані, то розчинником вважається компонент, якого є більша кількість.
Однорідність розчинів робить їх дуже подібними до хімічних сполук. Відмінність розчину від хімічних сполук полягає в тому, що склад розчину може змінюватися в широких межах. Несталість складу розчинів наближає їх о механічних сумішей, але від останніх вони різко відрізняються своєю однорідністю. Отже, розчини займають проміжне положення між механічними сумішами і хімічними сполуками.
2. Концентрація розчину – кількість розчиненої речовини, яка є в певній кількості розчину або розчинника. Розчини з великою концентрацією розчиненої речовини називаються концентрованими, з малою – розбавленими.
Способи вираження концентрації розчинів:
1) Числом одиниць маси розчиненої речовини, які є в 100 одиницях маси розчину (процентна концентрація або масова частка);
2) Числом молів розчиненої речовини, які є в 1 л розчину (молярна концентрація);
3) Числом еквівалентів розчиненої речовини, які є в 1 л розчину (нормальна концентрація);
4) Числом молів розчиненої речовини, які є в 1000 г розчинника (моляльна концентрація);
5) Відношенням числа молів певної речовини до загального числа молів усіх речовин, які є в розчині (мольна частка)
3. Розчинність – здатність речовини розчинятися в тому чи іншому розчиннику. Мірою розчинності речовини за певних умов є концентрація її насиченого розчину. Часто розчинність виражають числом одиниць маси безводної речовини, що насичує за певних умов 100 одиниць маси розчинника (коефіцієнт розчинності).
Звичайно речовини, що складаються з полярних молекул, і речовини з йонним типом зв’язку краще розчиняються у полярних розчинниках (вода, спирти, рідкий аміак), а неполярні речовини – в неполярних розчинниках (бензол, сірковуглець).
Розчинність більшості речовин зменшується із зниженням температури, тому при охолодженні гарячих насичених розчинів надлишок розчиненої речовини звичайно виділяється. Проте якщо охолоджувати обережно і повільно, захистивши при цьому розчин від можливості потрапляння у нього часточок розчиненої речовини ззовні, то виділення її з розчину може і не статися. У цьому випадку матимемо розчин, що містить значно більше розчиненої речовини, ніж її потрібно для насичення при певній температурі. Такі розчини називаються перенасиченими.
4. Розчин є гомогенною системою. Частинки розчиненої речовини і розчинника перебувають у безладному тепловому русі і рівномірно розподіляються по всьому об’єму розчину.
Якщо налити в циліндр концентрований розчин будь-якої речовини, наприклад цукру, а зверху нього обережно налити шар більш розбавленого розчину цукру, то утворена таким способом система спочатку буде неоднорідної. Але через деякий час молекули цукру і води знову рівномірно розподіляться по всьому об’єму рідини. Такий самовільний процес переміщення речовини, що приводить до вирівнювання її концентрації, називається двосторонньою дифузією.
Інакше буде, якщо ж між двома розчинами поставити перегородку, через яку розчинник може проходити, а розчинена речовина – не може.
 Візьмемо посудину з напівпроникними стінками, яка вгорі переходить у вузьку вертикальну трубку. Наповнимо посудину розчином цукру і зануримо в посудину з водою. Молекули води в більшій кількості дифундують у розчин, ніж назад, тому об’єм розчину поступово збільшуватиметься, а концентрація цукру в ньому зменшуватиметься (осмос – одностороння дифузія через напівпроникну перегородку). Внаслідок осмосу об’єм розчину поступово збільшуватиметься і розчин почне заповняти вертикальну трубку. Із підняттям рівня розчину в трубці виникатиме надлишковий тиск водяного стовпа, що вимірюється різницею рівнів рідини; цей тиск протидіє проникненню молекул води у розчин. Коли гідростатичний тиск досягне певної величини, осмос припиниться – настане рівновага. Гідростатичний тиск дорівнюватиме тому тиску, який є кількісною характеристикою осмосу, - осмотичному тиску розчину.
Візьмемо посудину з напівпроникними стінками, яка вгорі переходить у вузьку вертикальну трубку. Наповнимо посудину розчином цукру і зануримо в посудину з водою. Молекули води в більшій кількості дифундують у розчин, ніж назад, тому об’єм розчину поступово збільшуватиметься, а концентрація цукру в ньому зменшуватиметься (осмос – одностороння дифузія через напівпроникну перегородку). Внаслідок осмосу об’єм розчину поступово збільшуватиметься і розчин почне заповняти вертикальну трубку. Із підняттям рівня розчину в трубці виникатиме надлишковий тиск водяного стовпа, що вимірюється різницею рівнів рідини; цей тиск протидіє проникненню молекул води у розчин. Коли гідростатичний тиск досягне певної величини, осмос припиниться – настане рівновага. Гідростатичний тиск дорівнюватиме тому тиску, який є кількісною характеристикою осмосу, - осмотичному тиску розчину.
Прилад для вимірювання осмотичного тиску:
1 – посудина з водою; 2 – посудина з напівпроникними стінками; 3 - трубка
Величина осмотичного тиску залежить від концентрації розчину і його температури, але не залежить від природи розчиненої речовини і розчинника. Вант-Гофф встановив таку залежність:
P = 1000CRT, де
Р – осмотичний тиск розчину, Па
С – молярна концентрація,
Т- абсолютна температура розчину
5. При певній температурі тиск насиченої пари над кожною рідиною – величина стала. Досвід показує, що при розчиненні в рідині будь-якої речовини тиск насиченої пари цієї рідини знижується. Отже, тиск насиченої пари розчинника над розчином завжди нижчий, ніж над чистим розчинником при такій самій температурі. Різницю між цими величинами прийнято називати зниженням тиску пари над розчином.
Відношення величини цього зниження до тиску насиченої пари над чистим розчинником називається відносним зниженням тиску пари над розчином.
Позначимо тиск насиченої пари розчинника над чистим розчинником через р0, а над розчином – через р. Тоді відносним зниженням тиску пари над розчином буде дріб: 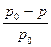 .
.
У 1887р. фізик Рауль, вивчаючи розчини різних нелетких рідин і речовин у твердому стані, встановив закон, що пов’язує зниження тиску пари над розбавленими розчинами неелектролітів з концентрацією:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 533; Нарушение авторских прав?; Мы поможем в написании вашей работы!