
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота №1 2 страница
|
|
|
|
 H
H
C2H6 C2H5Cl C2H5OH CH3-C =O
 H
H
кислоти нітросполуки аміносполуки сульфосполуки
 H-C=O CH3-NO2 CH3-NH2 CH3-SO3H
H-C=O CH3-NO2 CH3-NH2 CH3-SO3H
OH
 CH3-C=O C2H5-NO2 C2H5-NH2 C2H5-SO3Н
CH3-C=O C2H5-NO2 C2H5-NH2 C2H5-SO3Н
OH
Кожний ряд похідних вміщує характерну групу (-С=O, >C=O, -ОН та інші), яка називається функціональною групою. Всі органічні сполуки, які містять однакову функціональну групу, об’єднуються в класи (спирти, альдегіди, кислоти та інші).
Сполуки одного класу схожі за хімічною будовою, схожі за хімічними властивостями. Тому при вивченні того чи іншого класу сполук достатньо ознайомитись з властивостями всього декількох представників.
Тема: Вуглеводні
А. В молекулах насичених вуглеводнів атоми вуглецю зв’язані між собою простим зв’язком (s- зв’язок), утворюючи прямий або розгалуджений ланцюг.
Всі одиниці валентності атома вуглецю, не використані на зв’язок між вуглецевими атомами, насичені атомами водню.
Всі атоми зв’язані між собою тільки s-/сігма/ зв’язком - ковалентним зв’язком. Необхідно запам’ятати назву і формули перших десяти представників гомологічного ряду насичених вуглеводнів /алканів/, засвоїти принцип побудови гомологічного ряду. Цей принцип буде повторюватись при побудові всіх гомологічних рядів.
Найважливішою номенклатурою є міжнародна (систематична, ІЮПАК).
Використовується також тривіальна (випадкова) назва органічних сполук. Так, перші чотири члени гомологічного ряду алканів мають тривіальні назви:
CH4 - метан; C2H6 - етан; C3H8 - пропан; C4H10 - бутан.
Насичені вуглеводні за нормальних умов малоактивні сполуки. Пояснюється це тим, що всі атоми в молекулах зв’язані між собою s-зв’язками, які є міцними.
При підвищеній температурі, опромінюванні, дії активних реагентів вони вступають в реакції.
Так, при взаємодії хлору з метаном при опромінюванні світлом проходить реакція заміщення атомів водню на хлор.
H3C-H + Cl2 ® H3C-Cl + HCl
хлорметан
Ця реакція йде по ланцюговому радикальному механізму заміщення.
Cl: Cl  2Сl·
2Сl·
CH3: H + Cl· ® CH3· + HCl
CH3· + Cl: Cl ® CH3-Cl + Cl· і тощо…
При високих температурах проходять реакції розщеплення вуглецевого ланцюга молекул алканів (крекінг). Наприклад:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 
декан
® CH3-CH2· + ·CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 ®
етил (радикал) октил (радикал)
® CH2=CH2 + CH3-(CH2)6-CH3
етен октан
Б. Ненасичені вуглеводні (етиленові, дієнові, ацетиленові) мають в молекулах подвійні і потрійні зв’язки між атомами вуглецю (CH2=CH2; CH2=CH-CH=CH2; CHºCH). В зв’язку з цим треба звернути увагу на природу подвійного і потрійного зв’язків. Вуглеводні з такими типами зв’язків мають здатність легко вступати в різні реакції.
1. Реакції приєднання і полімеризації:
CH2=CH2 + Br2 ® CH2-CH2
ï ï 1, 2- диброметан
nCH2=CH2 ® [-CH2-CH2-]n поліетилен
2. Реакції окислення:
CH2=CH2 + [O] + H-OH  CH2-CH2
CH2-CH2
ï ï етандіол
OH OH
В. Ароматичні вуглеводні мають велике значення при одержанні фарбників, полімерів, фармацевтичних препаратів тощо.
Типовим представником ароматичних вуглеводнів є бензол. В молекулі бензолу немає звичайних простих і подвійних зв’язків
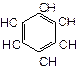
Всі зв’язки С-С рівноцінні по довжині і по енергії утворення. Електронна густина в молекулі бензолу розподіляється рівномірно:

Внутрішнє коло відображає замкнутий цикл з шести рухомих r-електронів.
Найбільш типовими реакціями бензолу і його гомологів є реакція електрофільного заміщення атомів водню на галоген, нітрогрупу (-NO2), сульфогрупу (-SO3H). У зв’язку з тим, що зв’язки в -CH- бензолу рівноцінні, то реакція заміщення водню може бути у кожного з атомів вуглецю.
При умові введення другого замісника в бензольне кільце, він буде направлятись першим замісником у зазначене положення. З метою вивчення цього питання необхідно знати правило заміщення в бензольному кільці.
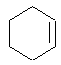
Г. Аліциклічні вуглеводні. Вивчаючи аліциклічні вуглеводні (циклоалкани), необхідно звернути увагу на міцність циклів, які складаються з різної кількості атомів вуглецю (теорія напруги) та залежність властивостей циклоалканів від розміру циклу. До аліциклічних сполук відносять терпени. Це особлива група ненасичених вуглеводнів складу C10H16. Вони входять до складу ефірних олій, скипидару¼ Вивчаючи терпени, слід звернути увагу на класифікацію. Для кожної з груп терпенів треба знати один-два представника: ациклічні терпени (мірцен, гераніол), моноциклічні (лімонен, ментол), біциклічні (пінен, камфора). У молекулах терпенів одна, дві або три подвійних зв’язка, різні функціональні групи. Терпени входять до складу ефірних олій, кропу, сельдирею, цитрусових, петрушки та ін.
Каротиноїди - природні пігменти (фарбники), які містяться в моркві, шипшині, помідорах і ще в багатьох рослинах. Молекули каротиноїдів вміщують спряжені подвійні зв’язки, що обумовлюють червоне або жовте забарвлення.
Найважливішим представником каротиноїдів є каротин. Каротин -C40H56- це три ізомери: a-каротин, b-каротин, g-каротин. b-каротину в цій суміші 85%.
СН3 СН3 СН3 СН3
 | |
| |
 С С
С С
 Н2С С(-СН=СН-С=СН-)2-СН=СН-(-СН=С-СН=СН-)2-С СН2
Н2С С(-СН=СН-С=СН-)2-СН=СН-(-СН=С-СН=СН-)2-С СН2
| |
Н2С С-СН3 СН3 СН3 Н3С-С СН2
СН2 b- каротин СН2
У чистому вигляді b- каротин являє собою жовті кристали нерозчинні у воді, а розчинні в жирах. В тваринних організмах під дією ферменту каротинази з однієї молекули b- каротину утворюється 2 молекули вітаміну А.
СН3 СН3
 |
|
-(-СН=СН-С=СН-)2-СН2ОН
|
-СН3 СН3 Вітамін А
Вітамін А в рослинних організмах не синтезується. Він міститься в молоці, яєчному жовтку, риб’ячому жирі, в печінці тварин.
Вітамін А - кристалічна речовина розчинна в жирах. Недостатня кількість вітаміну А в їжі приводить до порушення обмінних процесів, затримання росту, виснаження нервової системи, ороговіння шкіри.
b- каротин і вітамін А, накопичені в організмі, можуть зберігатися більше року, тому дуже корисно в літньо-осінній період вживати більше їжі, яка містить цей вітамін (морква, помідори, щавель, кропива, салат, зелена цибуля, абрикоси, персики, шипшина та ін.). Теплова кулінарна обробка мало впливає на зниження А-вітамінної активності.
Тема: Галогенопохідні
Для багатьох галагенопохідних насичених вуглеводнів важливою особливістю є легкість заміщення атому галогену на інші атоми або групи атомів. Ця особливість галагенопохідних використовується для одержання інших класів сполук (спиртів, альдегідів, кислот, ефірів¼).
Атом галогену при подвійному зв’язку (CH2=CH - хлорвініл)
ï
Cl
і в ароматичному ядрі (такого напрямку будови  хлорбензол)
хлорбензол)
утримується міцно. Заміщення галогену йде дуже повільно.
Тема: Спирти та феноли
Спирти - це похідні вуглеводнів, в молекулах яких один або декілька атомів водню заміщується на гідроксогрупу -OH. Група -OH є функціональною групою спиртів. По кількості гідроксильних груп спирти розподіляють на одноатомні і багатоатомні. Одноатомні спирти мають загальну формулу R-OH, де R - вуглеводневий радикал. Розрізняють первинні, вторинні і третинні спирти. Наприклад:
CH3-CH2-OH - первинний спирт CH3
етанол-1 ï
CH3-CH-CH3 – вторинний спирт CH3-C-CH3 – третинний спирт
ï ï
OH пропанол-2 OH 2-метил-пропанол-2
Багатоатомні спирти. Найважливішими представниками багатоатомних спиртів є етиленгліколь і гліцерин
CH2-OH CH2-OH
ï ï
CH2-OH CH-OH
етиленгліколь ï
CH2-OH гліцерин
Хімічні властивості спиртів обумовлені функціональною групою -OH. Спирти з лужними металами утворюють алкоголяти, з кислотами - складні ефіри, окиснюються, протікають реакції міжмолекулярної і внутрішньомолекулярної дегідратації.
Якісною реакцією на багатоатомні спирти є реакція з Cu(OH)2
CH2-OH CH2-O
ï ï ñCu
CH-OH + Cu(OH)2¯  CH-O
CH-O
ï ï
CH2-OH CH2-OH розчин гліцерату міді
Гідроксильна група може входити в склад сполук інших класів, проявляючи властивості притаманні цій функціональній групі.
Феноли.
Похідні ароматичних вуглеводнів, де у ароматичних ядрах замість атомів водню є група -ОН.



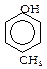
фенол о-крезол м-крезол п-крезол
Одноатомні феноли (ізомери по положенню групи -ОН у толуолі)
Багатоатомні феноли:



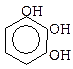
пірокатехін резорцин гідрохінон пірогалол
Феноли проявляють слабкі кислотні властивості, в розчинах дисоціюють: C6H5-O-H «C6H5O- + H+
Як кислоти феноли реагують з лугами:
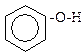 -Н
-Н 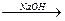 2О
2О 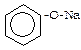 фенолят натрію
фенолят натрію
Феноли, як і спирти, за рахунок функціональної групи -ОН утворюють прості і складні ефіри, окиснюються.
Якісною реакцією на феноли є реакція з FeCl3. Різні феноли з цим реагентом дають різне забарвлення. За ароматичним ядром феноли вступають у реакцію заміщення водню на галоген, сульфогрупу, нітрогрупу.
Тема: Альдегіди і кетони
Альдегіди і кетони мають функціональну групу – С– карбонільну групу. ||
О
В альдегідах карбонільна група зв’язана з вуглеводневим радикалом і воднем: R – C – H
||
O
У кетонів карбонільна група зв’язана з двома вуглеводневими радикалами R– C– R
||
O
Альдегіди і кетони схожі у властивостях, так як мають однакову функціональну групу. Альдегіди називають по кількості атомів вуглецю з закінченням -аль. Часто альдегіди називають по кислотам, в які вони окиснюються.
H - C = O CH3 - C = O CH3 - CH2 - CH2 - C = O

 Н Н Н
Н Н Н
метаналь етаналь бутаналь
мурашиний альдегід оцтовий альдегід масляний альдегід
Кетони називають по кількості атомів вуглецю з закінченням -ОН. Прості кетони називають, перелічуючи радикали:
1 2 3
СН3 - C - СН3
||
O пропанон, диметилкетон
Альдегіди і кетони сполуки дуже активні. Основним типом хімічної реакції для альдегідів і кетонів є реакція приєднання водню і сполук, які мають легко рухомий водень (H2, H - CN, NaHSO3). Слід звернути увагу на те, що альдегіди легко окиснюються в кетони на відміну від кетонів, які окиснюються важко.
Якісними реакціями окиснення на альдегіди є реагенти: Cu(OH)2, Ag2O, реактив Фелінгу.
|

 CH3 - C = O
CH3 - C = O  CH3 - C = O
CH3 - C = O
H OH
оцтова кислота
Крім цього, для альдегідів і кетонів характерна реакція заміщення кисню, реакції в радикалі. Карбонільна група -С- входить до складу сполук інших класів. ||
О
Тема: Карбонові кислоти

 А. Карбоновими кислотами називають органічні сполуки, які мають в молекулах карбоксильну функціональну групу -С=О, зв’язану з вуглеводневим радикалом R - С = О О-Н
А. Карбоновими кислотами називають органічні сполуки, які мають в молекулах карбоксильну функціональну групу -С=О, зв’язану з вуглеводневим радикалом R - С = О О-Н
О-Н
По кількості карбоксильних груп карбонові кислоти розподіляють на одноосновні і багатоосновні.
Гомологічний ряд одноосновних карбонових кислот:
H - С = О - мурашина кислота,
 О-Н
О-Н
 CH3 - С = О - оцтова кислота,
CH3 - С = О - оцтова кислота,
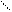 CH3 - CH2 - С = О - пропіонова кислота,
CH3 - CH2 - С = О - пропіонова кислота,
О-Н
 CH3 - CH2 - CH2 - С = О - масляна кислота,
CH3 - CH2 - CH2 - С = О - масляна кислота,
О-Н
CH3 - CH2 - CH2 - CH2 - С = О - валеріанова кислота,
 О-Н
О-Н
 CH3 - CH2 - CH2 - CH2 - CH2 - С = О - капронова кислота,
CH3 - CH2 - CH2 - CH2 - CH2 - С = О - капронова кислота,
О-Н
C15H31-СОOH - пальмітинова, C17H35С=ОО-Н- стеаринова кислоти.
Гомологічний ряд двохосновних карбонових кислот:
HOOC-СOOH - щавлева, HOOC-CH2-СОOH – малонова,
HOOC-CH2-CH2-СОOH - янтарна кислоти. Коли в радикалі є p- зв’язки, то такі кислоти відносять до ненасичених карбонових кислот:
 CH2 = CH - С = О - акрилова кислота,
CH2 = CH - С = О - акрилова кислота,
ОН
 CH2 = C - С = О - метакрилова кислота,
CH2 = C - С = О - метакрилова кислота,
| ОН
CH3
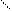 CH3-CH=CH-COOH - кротонова кислота, C17Н33-COOH - олеїнова кислота, C17H31-СОOH - лінолева кислота, C17H29-СОOH - ліноленова кислота. Карбонові кислоти частіше називають за тривіальною номенклатурою. Для всіх кислот характерні реакції з участю карбоксильної групи: -С=О
CH3-CH=CH-COOH - кротонова кислота, C17Н33-COOH - олеїнова кислота, C17H31-СОOH - лінолева кислота, C17H29-СОOH - ліноленова кислота. Карбонові кислоти частіше називають за тривіальною номенклатурою. Для всіх кислот характерні реакції з участю карбоксильної групи: -С=О
 О-Н
О-Н
 Зміщення електронної густини в карбоксилі: R - Cd+ = Оd-
Зміщення електронної густини в карбоксилі: R - Cd+ = Оd-
 О Н
О Н
Таке зміщення електронної густини приводить до дисоціації кислот



 R-Cd+ = Оd- R-C=О- + Н+
R-Cd+ = Оd- R-C=О- + Н+
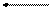
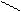 ОН О –
ОН О –
Всі карбонові кислоти мають кислотні властивості: змінюють забарвлення індикаторів, утворюють солі. Карбонові кислоти можуть давати похідні, коли -ОН в карбоксилі заміщується на іншу групу атомів. Похідні карбонових кислот активні сполуки і їх застосовують в органічному синтезі. R - С = О - галогенпохідні,
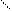 Cl
Cl
R - C - O - С - R - ангідриди,
|| ||
O О
R - C - O - R - складні ефіри,
||
O
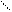 R - С = О – аміди.
R - С = О – аміди.
NH2
В хімічних реакціях беруть участь і вуглеводневі радикали кислот. Радикали насичених і ненасичених кислот по різному реагують з одним і тим же реагентом.
1) Реакція заміщення водню:
|
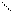 CH3 - CH2 - С = О
CH3 - CH2 - С = О 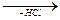 CH3 - CH - СОOH
CH3 - CH - СОOH
ОН |
пропіонова кислота Cl 2-хлорпропіонова кислота
2) Реакція приєднання:
|
CH2=CH - СООН  CH2 - CH - СООН
CH2 - CH - СООН
| |
пропенова кислота Cl Cl 2, 3 - дихлорпропанова кислота
Зверніть увагу на здатність ненасичених кислот приєднувати водень:
CH3-(CH2)7-CH=CH-(СH2)7-COO 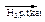 CH3-(CH2)8-CH2-(СH2)7-COOH
CH3-(CH2)8-CH2-(СH2)7-COOH
олеїнова кислота (рідина) стеаринова кислота (тверда)
Така реакція лежить в основі перетворення рідких олій в тверді жири.
Карбоксильна група входить до складу сполук інших класів.
Б. Ароматичними кислотами називають похідні ароматичних вуглеводнів, де карбоксильна група знаходиться біля ароматичного кільця:  бензойна кислота. Ароматичні кислоти проявляють типові властивості по карбоксильній групі. У ароматичному ядрі ідуть реакції заміщення на галоген, сульфогрупу (-SO3H...).
бензойна кислота. Ароматичні кислоти проявляють типові властивості по карбоксильній групі. У ароматичному ядрі ідуть реакції заміщення на галоген, сульфогрупу (-SO3H...).
Двохосновні ароматичні кислоти:
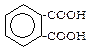

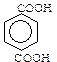
фталева ізофталева терефталева
Деякі з них широко застосовуються в органічному синтезі.
Тема: Естери. Жири
Складні ефіри є похідними кислот, спиртів і мають загальну формулу:
R-C-O-R R - C - кислотний радикал - O - R - залишок спирту
|| ||
O O
Назву складних ефірів складають з назви кислоти і спирту.
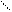 CH3-C=О + HO-CH3
CH3-C=О + HO-CH3 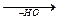 CH3-C-O-CH3
CH3-C-O-CH3
ОН ||
оцтова метиловий О
кислота спирт оцтовометиловий складний ефір
Складні ефіри розповсюджені в природі. Аромат квітів, плодів, ягід залежить в значній мірі від наявності в них складних ефірів.
Жири - складні ефіри, утворені гліцерином і жирними кислотами. Такі ефіри називають гліцеридами.
O
||
CH2-OH CH2-O-C-C17H35
O
ï ï ||
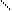 CH-OH + 3C17H35-С=О
CH-OH + 3C17H35-С=О 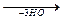 CH-O-C-C17H35
CH-O-C-C17H35
ОН O
ï ï ||
CH2-OH CH2-O-C-C17H35
В утворенні жирів беруть участь близько 50 різних кислот. Частіше всього зустрічаються кислоти: стеаринова, пальмітинова, олеїнова, лінолева... (див. тему «Кислоти»). Жири, молекули яких утворені більшою кількістю насичених кислот - тверді, а коли утворені більшою кількістю ненасичених кислот - рідкі. Міру ненасиченості жиру визначають йодним числом. Жири як складні ефіри вступають в реакцію гідролізу: O
||
CH2-O-C-C17H35
O CH2-OH
ï || ï
CH-O-C-C17H35 +3H-OH  CH-OН + 3C17H35COOH
CH-OН + 3C17H35COOH
O ï
ï || CH2-OH
CH2-O-C-C17H35 гліцерин стеаринова кислота
Гідроліз жиру в присутності лугу - лужний гідроліз. Цим методом одержують мило:
O
||
CH2-O-C-C17H35
O CH2-OH
ï || ï
CH-O-C-C17H35 + 3NaOH  CH-OH + 3C17H35COONa
CH-OH + 3C17H35COONa
O ï
ï || CH2-OH мило
CH2-O-C-C17H35
Рідкі жири реагують з воднем. Таким чином одержують тверді жири з рідких. Жири - одна з головних складових частин їжі людини. При зберіганні жири псуються. Визначають стадії псування жирів: прокисання, прогіркання, осалювання.
Тема: Оксикислоти (спиртокислоти)
А. Оксикислоти відносять до сполук з двома функціональними групами: -ОН та - СООН.
a
CH2- COOH CH3-CH- COOH
ï ï
OHOH
оксиоцтова кислота a-оксипропіонова кислота
В цій темі вивчається Оксикислоти, в основному, проявляють властивості як спиртів, так і кислот. Важливо вміти пристосувати до нової теми раніше вивчений матеріал.
оптична активність сполук, оптична ізомерія. Оптична активність притаманна багатьом представникам органічних сполук. В рекомендованій літературі оптична активність викладена добре.
Б. Фенолокислоти - оксипохідні (фенолопохідні) ароматичних кислот. Найважливішими представниками є:
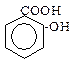

о-оксибензойна кислота триоксибензойна кислота
(саліцилова) (галова)
Фенолокислоти проявляють властивості фенолів і карбонових кислот (див. теми: Феноли. Карбонові кислоти). Крім цього, проходять типові реакції заміщення водню в ароматичному ядрі. (див. тему: Ароматичні вуглеводні).
Фенолокислоти широко розповсюджені в природі. В рослинах вони беруть участь в утворенні складних ефірів. Галова кислота входить до чаю, дубильних речовин.
Дубильні речовини входять до складу чаю, хмелю, яблук, ягід... Вони утворюють гіркуватий, терпкий присмак, запобігають псуванню, так як мають антисептичні властивості. До дубильних речовин відносять таніни і катехіни. Перші - гідролізуються, другі - ні. Таніни - складні ефіри, катехіни - конденсовані фенольні ядра.
Тема: Вуглеводи
Для засвоєння матеріалу цієї теми треба насамперед засвоїти класифікацію вуглеводів. Слід звернути увагу на прості вуглеводи та складні. Вивчаючи прості вуглеводи, слід звернути увагу на їх будову, на присутність раніше вивчених функціональних груп: -ОН, -С-, -С=О.
ïê \
О Н
Вуглеводи повинні мати властивості спиртів, альдегідів, кетонів. Прості вуглеводи (моноцукри) вивчають на прикладах глюкози, фруктози. На цих представниках слід розібратися в явищі таутомерії як одного з видів ізомерії. На прикладах ізомерах - таутомерах засвоїти властивості циклічних структур простих вуглеводів.
Складні вуглеводи поділяються на найбільш поширені - дисахариди і несахароподібні вищі полісахариди. Звернути увагу на будову і властивості мальтози, лактози, сахарози.
Вивчити будову і властивості найбільш типових представників полісахаридів: крохмалю, клітковини. При вивченні вуглеводів повинна сформуватись система знань: розчиняються вуглеводи у воді чи ні; які вуглеводи гідролізуються та які сполуки при цьому одержують; які вуглеводи окиснюються і відносяться до редукуючих вуглеводів і які не окиснюються і відносяться до нередукуючих вуглеводів. У групі вищих полісахаридів слід звернути увагу на пектинові сполуки, які застосовуються в харчовій промисловості.
Тема: Аміни
Аміни можна уявити як похідні аміаку, в молекулі якого атоми водню заміщуються на вуглеводневі радикали. Розрізняють аміни: первинні, вторинні, третинні. Назви амінів складаються за тими радикалами, які входять до молекул, з додатком слова - амін.
NH3; а) СН3-NН2 б) CН3 в) СН3
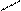

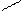
 аміак первинний NH N– СН3
аміак первинний NH N– СН3
метиламін СН3 CH3
вториннний амін третинний амін
диметиламін триметиламін
Подібно до аміаку, аміни виявляють основні властивості. Аміни - органічні основи. Вони можуть реагувати з кислотами, а низькомолекулярні аміни реагують з водою. Основні властивості амінів забезпечуються власною електронною парою атома азоту, до якої притягуються протони водню:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 692; Нарушение авторских прав?; Мы поможем в написании вашей работы!