
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості елементів і їх сполук знаходяться в періодичній залежності від величини заряду ядер атомів
ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ І БУДОВА АТОМА
Сучасне формулювання періодичного закону Д.І.Менделєєва:
Якщо провести аналогію між будовою електронної оболонки атома і положенням елемента в системі, можна зробити цікаві висновки.
Кожний період починається з елементів, у яких з’являється s-електрони нового електронного шару. Внаслідок схожої структури зовнішнього електронного шару, такі елементи проявляють багато спільного і в своїх хімічних властивостях. Тому вони відносяться до сімейства s-елементів. Отже, до s-елементів відносяться елементи головних підгруп І і ІІ групи системи. Всі вони, за виключенням водню є активними металами.
Починаючи з третьої до восьмої групи в головних підгрупах заповнюється р-підрівень зовнішнього електронного шару. Ці елементи відносяться відповідно до сімейства р-елементів. Вони проявляють неметалічні властивості, за виключенням амфотерних елементів.
Десять d-елементів – починаючи від скандію до цинку – належать до перехідних елементів. У них заповнюється не зовнішній (n = 4), а передостанній (n =3) електронний шар. Тому хімічні властивості елементів d-елементів із зростанням порядкового номера змінюється не так різко, як у s- і р-елементів. Всі d-елементи належать до металів, тоді як заповнення зовнішнього р-підрівня веде до переходу від метала до типового неметалу, і нарешті до інертного елементу.
Хімічні властивості елементів визначає:
1. Заряд ядра атома.
2. Радіус атома.
Чим більше радіус атома, тим легше атом віддає свої валентні електрони.
3. Кількість валентних електронів.
В ПЕРІОДИЧНІЙ СИСТЕМІ:
1. Порядковий номер елемента показує кількість протонів і кількість електронів в атомі.
2. Номер періоду показує число енергетичних рівнів в атомі.
3. Номер групи показує кількість електронів на зовнішніх підрівнях і для більшості елементів дорівнює максимальному ступеню окислення елемента.
ЗМІНА ВЛАСТИВОСТЕЙ ЕЛЕМЕНТІВ ПО ПЕРІОДАМ.
В періоді атоми мають однакову кількість рівнів.
В кожному періоді із збільшенням порядкового номера:
- збільшується число валентних електронів;
- радіус атомів зменшується, оскільки збільшується позитивний заряд ядра, і електрони сильніше притягуються до ядра;
- енергія іонізації і спорідненості до електрону збільшується;
- металічні властивості елементів слабшають, а неметалічні посилюються.
ЗМІНА ВЛАСТИВОСТЕЙ ЕЛЕМЕНТІВ ПО ГРУПАМ.
В кожній групі атоми елементів мають однакову кількість електронів на зовнішньому рівні.
В кожній головній підгрупі із збільшенням порядкового номера елемента:
- кількість валентних електронів постійна;
- радіус атомів збільшується, оскільки збільшується кількість енергетичних рівнів;
- енергія іонізації зменшується;
- металічні властивості елементів посилюються.
Наприклад: елементи ІА групи:
-----------------------------------------------------
Елемент № періода заряд ядра К-сть ва- Радіус
лентних ел. атома, нм
------------------------------------------------------
Li 2 3 1 0,155
Na 3 11 1 0,189
K 4 19 1 0,236
Rb 5 37 1 0,248
Cs 6 55 1 0,262
------------------------------------------------------
В цій групі типові метали - лужні метали.
Метали відрізняються один від одного АКТИВНІСТЮ. Чим легше метал віддає електрони, тим він активніше.
Найактивніший метал – цезій, оскільки він має самий більший радіус і легко віддає електрони.
Приклад: елементи VII A групи:
-----------------------------------------------------
Елемент № періода заряд ядра К-сть ва- Радіус
лентних ел. атома, нм
------------------------------------------------------
F 2 9 7 0,067
Cl 3 17 7 0,099
Br 4 35 7 0,120
I 5 53 7 0,136
-----------------------------------------------------
В цій групі знаходяться ТИПОВІ НЕМЕТАЛИ (галогени)
самий активний неметал - фтор, оскільки він має найменший радіус і легко приймає електрони.
Елементи кожної групи утворюють СПОЛУКИ ОДНАКОВОГО ТИПУ. Наприклад, оксиди металів І А групи мають однакову формулу Е2О і аналогічні властивості.
Періодичність у зміні властивостей хімічних елементів і їх сполук..
Властивості елементів визначаються електронною конфігурацією зовнішнього рівня. максимально заповнені орбіталі є найбільш стійкими. Елементи, які мають незаповнені (незавершені), при хімічних реакціях віддають або приєднують електрони.
Віддача або приєднання електронів супроводжується енергетичними ефектами.
ЕНЕРГІЯ, яку необхідно використати для відриву електрона від атому, називається енергією іонізації (І).
Вона залежить від заряду ядра і радіуса атома. Чим більше радіус атома і чим менше електронів на зовнішньому енергетичному рівні, тим менше енергія іонізації. Найменша енергія іонізації у елементів 1 групи (за виключенням водню). Ці елементи є типовими металами. Характерною властивістю їх є відносно легка віддача електронів. Таким чином, енергія іонізації є мірою проявлення металічних властивостей.
Мірою здібності елемента проявляти неметалічні властивості служить спорідненість до електрону. ЕНЕРГІЯ, яка виділяється при приєднанні електрона до атому, називається енергією спорідненості до електрону (Е). Спорідненість до електрону збільшується із зменшенням радіуса атома і збільшенням кількості електронів на зовнішньому енергетичному рівні.
Оскільки деякі елементи згідно електронної будови їх атомів можуть як віддавати так і приєднувати електрони, було введено поняття “електронегативність ”, яке враховує обидві енергії. Величина електронегативності визначається арифметичною сумою енергії іонізації і спорідненості до електрону.
Чим більше електронегативність, тим сильніше елемент проявляє неметалічні властивості. Наприклад, в періоді зліва направо збільшується заряд ядра, кількість електронів на зовнішньому рівні, а отже, збільшується енергія іонізації і спорідненості до електрону. І відповідно, збільшується електронегативність, тому металічні властивості у елементів зменшуються.
Розглянемо, як змінюється електронегативність в групах на прикладі головної підгрупи IV групи. Кількість електронів на зовнішньому рівні у всіх елементів однакова, але вони знаходяться на різних рівнях (2,3,4,5,6), тобто на різних відстанях від ядра. Із збільшенням радіуса зменшується енергія іонізації і спорідненості до електрону, отже зменшується електро-негативність, а металічні властивості зверху вниз по групі посилюються.
Таким чином, сучасні уявлення про будову атома відкрили нові закономірності, які пов’язують властивості елементів з їх положенням в періодичній системі. Тому періодичний закон Д.І.Менделєєва формулюється так:
*Властивості елементів, а також форми і властивості їх сполук знаходяться в періодичній залежності від величини заряда ядра атома (порядкового номера).
Хімічний зв’язок і будова молекул
Під хімічним зв’язком слід розуміти силу, яка діє між атомами і забезпечує сполучення їх у молекулу або кристал. Сучасна наука розглядає утворення хімічного зв’язку як процес, при якому загальна енергія системи електронів і ядер атомів, що взаємодіють, зменшується. Зменшення енергії зумовлене тим, що електрони одночасно притягуються до двох ядер. Внаслідок перекривання електронних хмар при зближенні атомів у просторі між ядрами цих атомів виникає область підвищеної густини негативного електричного заряду. Позитивно заряджені ядра притягуються в напрямку цієї області перекривання електронних хмар, що й забезпечує стійкість молекули.
Отже, хімічний зв’язок - це наслідок взаємодії електронів і ядер атомів, що приводить до зменшення енергії системи.
Відомо кілька типів хімічного зв’язку. Основними є ковалентний та іонний. Всі типи хімічних зв’язків мають електронну природу. Сполучення атомів різних елементів у молекулу зумовлене їх прагненням до утворення енергетично найстійкіших електронних систем - завершених зовнішніх електронних шарів.
(2)
Розглянемо механізми утворення найбільш універсального ковалентного зв’язку.
Відомо, що найстійкішими є електронні оболонки, в яких всі електрони спарені, оскільки в цьому випадку вони перебувають у стані найменшого енергетичного напруження. При спарюванні двох електронів з однаковими енергіями і з антипаралельними спінами їх стан стабілізується, а енергія знижується.
Якщо під час сполучення двох атомів утворюються спільні пари електронів, що обертаються у полі ядер обох атомів, то такий зв’язок називається ковалентним. Ковалентний зв’язок може утворюватись за участю двох, чотирьох і шести узагальнених електронів.
Ковалентний зв’язок характеризується поляризованістю, насичуваністю, напрямленістю.
Процес “спаровування” електронів під час утворення молекули водню можна подати такою схемою:

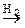



Хвилясті лінії на схемі означають, що в молекулі водню кожен електрон знаходиться на орбіталях не вихідних атомів, а рухається в силовому полі, утвореному двома ядрами атомів водню. Якщо валентні електрони позначити крапками, то ковалентний зв’язок між атомами водню можна зобразити схемою:
Н. +Н.  Н:Н + 436 кДж.
Н:Н + 436 кДж.
Наближений квантово-механічний розрахунок молекули водню, зроблений В.Гейтлером і Ф.Лондоном, згодом був використаний для пояснення механізму утворення хімічного зв’язку в складніших молекулах і став відправним пунктом для розвитку теорії хімічного зв’язку, що дістала назву метод валентних зв’язків (ВЗ).
Основу методу ВЗ становлять такі положення:
1. Ковалентний зв’язок утворюється двома електронами з протилежно напрямленими спінами; спільна пара електронів належить обом атомам. Всі можливі хімічні зв’язки у молекулі можна представити як комбінації двоцентрових двохелектронних зв’язків.
2. Міцність ковалентного зв’язку визначається мірою перекривання електронних хмар атомів, між якими виникає зв’язок: чим повніше перекриваються електронні хмари, тим міцніший зв’язок.
Якщо атоми у молекулі сполучені за допомогою однієї спільної пари електронів (одного зв’язку), то зв’язок носить назву ординарного. Коли зв’язок між атомами здійснюється за допомогою двох спільних пар електронів, - подвійним, якщо ж атоми сполучені трьома хімічними зв’язками, - потрійним. Ця властивість носить назву кратності ковалентного зв’язку.
Утворення ковалентного зв’язку між атомами фтору, кисню і азоту можна подати схемами:
F + F  F F + 159 кДж (F-F)
F F + 159 кДж (F-F)
O + O  O O + 498,7 кДж (O=O)
O O + 498,7 кДж (O=O)
N + N  N N + 945,6 кДж (N N)
N N + 945,6 кДж (N N)
Отже, навколо кожного атома утворюється стійка конфігурація із восьми електронів. З наведених схем також видно, що утворення потрійного зв’язку між атомами азоту супроводжується виділенням найбільшої кількості енергії, тому молекула азоту характеризується високою стійкістю, чим і пояснюється хімічна пасивність азоту.
Важливою характеристикою хімічного зв’язку є енергія його утворення, що чисельно дорівнює зміні енергії внаслідок протікання такого процесу:
А + А  А2 + D
А2 + D
(1 моль ат.) (1 моль ат.) (1 моль мол.)
Величина D називається енергією зв’язку. Чисельно вона дорівнює кількості теплоти, що виділяється під час утворення з атомів 6,02.1023 молекул за стандартних умов. Величина, обернена величині D, називається енергією дисоціації (розриву) зв’язку.
Другою важливою характеристикою зв’язку є рівноважна між’ядерна відстань, що називається довжиною зв’язку.
Число спільних пар електронів, що сполучають атом даного елемента з іншими атомами, тобто число ковалентних зв’язків, які утворює атом, називається ковалентністю елемента у відповідній сполуці. Так, ковалентність азоту в молекулах N2 i NH3 дорівнює трьом, ковалентність кисню у молекулах Н2О і СО2 - двом.
Ковалентний зв’язок утворюється переважно при сполученні атомів неметалів. Серед простих речовин і хімічних сполук з ковалентним зв’язком є тверді, рідкі та газоподібні речовини.
Типовий ковалентний зв’язок виникає між атомами одного елемента, наприклад, в молекулах водню, кисню, азоту, тощо. Спільна пара електронів, за допомогою якої здійснюється ковалентний зв’язок, розміщується у просторі симетрично відносно ядер обох атомів. Такий ковалентний зв’язок називається неполярним або гомеополярним. Неполярний ковалентний зв’язок може утворитися не тільки між однаковими атомами, але й між атомами з близькими електронегативностями. Якщо ж електронегативності атомів, що сполучаються між собою, відрізняються, то спільна пара електронів зміщується в бік одного з цих атомів. При цьому порушується симетрія розподілу електричного заряду. З одного кінця такого зв’язку буде надлишок позитивного заряду, а з другого - негатичного.
Полярний, або гетерополярний, зв’язок - це такий ковалентний зв’язок, що характеризується зміщенням спільної пари електронів в бік одного з атомів.
Зміщення спільної пари електронів при утворенні полярного ковалентного зв’язку призводить до того, що середня густина негативного електричного заряду буде вищою поблизу більш електронегативного атома і нижчою - поблизу менш електронегативного. Отже, один атом набуде надлишкового негативного, а другий - надлишкового позитивного заряду. Ці заряди називаються ефективними (реальними) зарядами атомів у молекулі.
Прикладів утворення полярних зв’язків можна навести дуже багато. Так, під час сполучення атома водню з атомом хлору зв’язуюча їх електронна пара зміщується в бік атома хлору, що зумовлює виникнення на атомі хлору негативного заряду, який дорівнює 0,17 зяряду електрона, а на атомі водню - позитивного заряду, який дорівнює такій самій величині. Молекула Н+0,17СІ-0,17 є полярною молекулою. Її можна розглядати як систему двох однакових за абсолютною величиною, але протилежних за знаком зарядів, що знаходяться на певній відстані один від одного. Такі системи називаються електричними диполями.
Залежно від того, між якими парами атомів виникає полярний зв’язок, центри позитивних і негативних зарядів у молекулі можуть розміщуватись на різних відстанях один від одного. Отже, диполі, що утворюються, відрізняються за своєю полярністю. Полярність молекули кількісно оцінюють величиною дипольного моменту  , що є добутком абсолютного значення заряду електрона на відстань між центрами позитивного і негативного зарядів у молекулі:
, що є добутком абсолютного значення заряду електрона на відстань між центрами позитивного і негативного зарядів у молекулі:  = ql, де q - заряд електрона; l- відстань між центрами зарядів, або довжина диполя.
= ql, де q - заряд електрона; l- відстань між центрами зарядів, або довжина диполя.
Довжина диполя - величина порядку розміру молекули (10-10 м), заряд електрона становить 1,602.10-19 Кл. Дипольні моменти вимірюють у кулон-метрах.
У багатьох молекулах, подібних за будовою, дипольний момент зростає із збільшенням різниці електронегативностей атомів, що входять до складу молекули. Так, дипольні моменти HCl, HBr, i HI дорівнюють відповідно 1,04; 0,79; 0,38D (1D = 3,33.10-30Кл.м).
Дипольні моменти неполярних молекул (O2, H2, N2 тощо) дорівнюють нулю; дипольні моменти молекул з полярним ковалентним зв’язком більші від нуля, але менші від 4D, дипольні моменти молекул з іонним зв’язком знаходяться в межах 4 - 11 D.
|
|
Дата добавления: 2015-05-24; Просмотров: 1564; Нарушение авторских прав?; Мы поможем в написании вашей работы!