
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізми утворення ковалентного зв’язку
|
|
|
|
Ковалентний зв’язок може здійснюватись спільною парою електронів, яка утворюється неспареними електронами двох атомів, що взаємодіють.
Проте число ковалентних зв’язків може бути і більшим, ніж число наявних у незбудженого атома неспарених електронів. Так, атом вуглецю в незбудженому стані у зовнішньому шарі має тільки два неспарених електрони, тобто здатний утворювати два ковалентних зв’язки. Проте для вуглецю характерні сполуки, у яких він чотиривалентний (СН4, СО2 тощо). Це стає можливим завдяки “розпаровуванню” електронів під час збудження атома вуглецю:
2s2 2p2 2s1 2p3
С 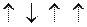
 С*
С* 
При цьому у зовнішньому електронному шарі атома вуглецю міститиметься вже чотири неспарених електрони, тобто збуджений атом вуглецю може брати участь в утворенні чотирьох ковалентних зв’язків. Збільшення числа ковалентних зв’язків супроводиться виділенням більшої кількості енергії, ніж затрачено на збудження атома.
Однак механізм утворення ковалентного зв’язку може бути й іншим. Розлянемо для прикладу утворення ковалентного зв’язку в молекулі оксиду вуглецю(ІІ) СО.
Атом вуглецю в незбудженому стані має два неспарених електрони 1s22s22p2. В атомі кисню є теж тільки два неспарених електрони 1s22s22p4. Внаслідок “спаровування” двох пар електронів атомів кисню і вуглецю у молекулі оксиду вуглецю (ІІ) утворюються дві спільні пари електронів:
С + О  С О.
С О.
При цьому навколо атома кисню утворюється стійка восьмиелектронна конфігурація, а навколо атома вуглецю такої стійкої конфігурації немає.
Атом кисню містить на зовнішньому шарі ще неподілені пари електронів, а атом вуглецю - вільну р -орбіталь. Тому кратність валентності у молекулі СО підвищується за рахунок донорно-акцепторного зв’язку, що утворюється в результаті переходу неподіленої пари електронів атома кисню на вільну орбіталь атома вуглецю. В цьому разі досягається стійка восьмиелектронна конфігурація навколо кожного з атомів С О. Тому молекулу СО записують так: С О.
Формула показує, що в молекулі СО атом вуглецю сполучений з атомом кисню трьома хімічними зв’язками. З трьох спільних пар електронів дві утворилися шляхом спаровування електронів двох атомів, що взаємодіяли. Третя пара електронів належала спочатку тільки атому кисню, який є донором електронної пари відносно атома вуглецю, а атом вуглецю - акцептором цієї пари електронів.
Хімічний зв’язок, що виникає між атомами в результаті узагальнення пари електронів, що належала одному з них, дістав назву ковалентного, утвореного за донорно-акцепторним механізмом.
Отже, ковалентний зв’язок за донорно-акцепторним механізмом виникає внаслідок переміщення зв’язуючої пари електронів одного атома (донора) на вільну орбіталь другого атома (акцептора).
Наприклад, утворення іона амонію:
Зазначимо, що всі чотири зв’язки в іоні амонію рівноцінні, незважаючи на те, що три з них утворились як звичайні ковалентні зв’язки, а четвертий - за донорно-акцепторним механізмом; заряд цього іона (+1) належить не якомусь одному з атомів, що утворюють іон, а іонові в цілому. Тому будову його записують так:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1120; Нарушение авторских прав?; Мы поможем в написании вашей работы!