
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа хімічної рівноваги
|
|
|
|
Необоротні і оборотні хімічні реакції. Хімічна рівновага в гомогенних і гетерогенних системах.
Хімічні реакції бувають оборотні і необоротні. Необоротні реакції протікають до тих пір, поки не витратиться одна з реагуючих речовин, тобто до кінця. Як правило, в результаті необоротніх реакцій утворюється газоподібна речовина, або важкорозчинна речовина (осад), або комплексна сіль. Оборотні реакції протікають не до кінця, при цьому жодна з реагуючих речовин не витрачається повністю. Оборотна реакція може відбуватися як у прямому, так і в зворотньому напрямках.
Так, наприклад, реакція розкладу калій перманганату є необоротньою:
2KMnO4 ®K2MnO4 + MnO2 ¯ + O2
Кінцеві продукти цієї реакції не можна сполучити між собою так, щоб утворилась вихідна речовина.
Реакція взаємодії сульфур диоксиду з киснем при наявності каталізатору 2SO2 + O2 Û 2SO3 є оборотньою, оскільки при температурі 4000С вона майже на 100% протікає у прямому напрямку, а при підвищенні температури до 4500 С стає помітним розклад сульфур триоксиду, тобто за цих умов одночасно протікають як пряма, так і зворотна реакції. Більшість хімічних реакцій належить до оборотних.
Стан системи реагуючих речовин (оборотної реакції), при якому швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою.
Кількісною характеристикою хімічної рівноваги є її константа. Розглянемо це на прикладі взаємодії сульфур диоксиду з киснем:
2SO2 + O2 Û 2SO3
Швидкість прямої реакції, згідно з законом діючих мас мас, дорівнює: V1 = k1[SO2]2[O2],
Швидкість зворотної реакції: V2 = k2 [SO3]2
В момент встановлення стану хімічної рівноваги V1=V2, тобто
k1[SO2]2[O2] = k2 [SO3]2, або 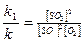 .
.
Відношення k1/k2 є також сталою величиною, тому останнє рівняння можна записати так: 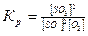 .
.
Отже, в момент встановлення хімічної рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин є величина стала. Ця величина називається константою хімічної рівноваги.
Константа хімічної рівноваги визначає глибину протікання процесу в момент досягнення стану рівноваги. Чим більша величина Кр тим повніше взаємодіють речовини. Повнота протікання процесу залежить від концентрації реагентів. Знаючи величину Кр, можна обчислити теоретично можливий вихід продуктів реакції. Величина константи хімічної рівноваги залежить від природи реагуючих речовин, температури і не залежить від тиску (при не дуже високому його значенні), концентрації реагуючих речовин і продуктів реакції та від наявності чи відсутності домішок. Каталізатор в однаковій мірі змінює швидкість як прямої, так і зворотньої реакції і таким чином сприяє швидшому досягненню стану рівноваги.
Стан хімічної рівноваги залишається незмінним до тих пір, поки не зазнають змін зовнішні умови (температура, тиск, концентрація). Коли ж змінити ці умови, то рівновага системи порушиться. Це пояснюється тим, що при зміні зовнішніх умов швидкості прямої та зворотньої реакцій стають різними; швидкість однієї з двох реакцій переважає над іншою, в результаті чого хімічна рівновага порушується.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1699; Нарушение авторских прав?; Мы поможем в написании вашей работы!