
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив зовнішніх факторів на хімічну рівновагу
|
|
|
|
Вплив зміни зовнішніх умов на стан хімічної рівноваги визначається за правилом, яке дістало назву принципу ле Шательє (1884 р), або принципу рухомої (динамічної) рівноваги: якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють, або знищують цю дію.
Вплив концентрації на стан рівноваги.
Згідно з принципом ле Шательє, введення в систему, що перебуває в стані рівноваги, додаткової кількості будь-якої з реагуючих речовин викликає зміщення рівноваги у тому напрямку, в якому її концентрація зменшується. Ось чому додавання в систему однієї з вихідних речовин спричиняє зміщення рівноваги вправо, а додавання продуктів реакції – вліво.
Якщо напрямок зміщення рівноваги в системі залежить від того, який з реагентів беруть у надлишку, то ступінь зміщення рівноваги при введенні певної кількостіреагента визначається стехіометричними коефіцієнтами речовин, що беруть участь у реакції. Так, наприклад, введення додаткової кількості водню в
систему Н2 + I2 Û2HI, що перебуває у стані рівноваги за певних температурі і тиску, спричинить зростання швидкості прямої реакції, а швидкість зворотньої реакції не зміниться, внаслідок чого рівновага порушиться. Зростання швидкості прямої реакції зумовить зменшення концентрації водню і парів йоду, що в свою чергу, призведе до сповільнення прямої реакції. В цей самий час концентрайція НІ збільшуватиметься, що спричинить прискорення зворотньої реакції. Через деякий час знову встановиться стан хімічної рівноваги – швидкості прямої і зворотньої реакцій вирівняються, при цьому концентрація НІ стане вищою, а концентрація І2 – нижчою, ніж до того, як додали Н2.
Отже, при збільшенні концентрації однієї з реагуючих речовин у системі, що перебувала у рівновазі, рівновага зміщується в бік витрати цієї речовини.
Вплив тиску на стан рівноваги. Для газових систем на стан хімічної рівноваги впливає тиск, оскільки із збільшенням тиску зростає концентрація газових компонентів в даній системі. Реакції, що супроводжуються зменшенням об’єму, легше проходять при підвищеному тиску. Отже, згідно з принципом Ле Шательє, підвищення тиску зумовлює зміщення хімічної рівноваги в напрямку процесу, який супроводжується зменшенням об’єму, а зниження тиску – викликає зміщення рівноваги у протилежний бік. Отже, напрямок зміщення рівноваги визначається знаком DV. При обчисленні DV можна знехтувати об’ємом негазоподібних реагентів.
Для реакції утворення аміаку, що записується рівнянням:
N2 + 3H2 Û 2NH3,
В стані рівноваги швидкості прямої V1 становитиме: V1 = k1[N2][H2]3,
Швидкість зворотної реакції: V2 = k2 [NH3]2.
Підвищення тиску вдвічі (при сталій температурі) зумовить зменшення об’ємів вдвічі, що призведе до збільшення концентрацій реагуючих речовин в два рази. У перший момент після підвищення тиску концентрації газів у системі матимуть значення: 2[H2], 2[N2]; 2[NH3], а швидкості прямої і зворотньої реакцій дорівнюватимуть:
V’1 = k12[N2](2[H2])3 =16 k1[N2][H2]3= 16 V1;
Швидкість зворотної реакції: V’2 = k2 (2[NH3])2 = 4k2[NH3]2=4V2.
Із сказаного вище можна зробити висновок, що при підвищенні тиску рівновага зміщується в бік зменшення числа молекул газів, тобто в бік зниження тиску, а при зниженні тиску – в бік збільшення числа молекул газів, тобто в бік підвищення тиску.
Вплив температури на стан рівноваги.
Напрямок зміщення рівноваги внаслідок зміни температури визначається знаком теплового ефекту, ступінь зміщення рівноваги – абсолютною величиною теплового ефекту. Чим більше DH, тим значніший вплив температури, і, навпаки, якщо величина DH близька до нуля, то зміна температури практично не впливає на стан рівноваги. Наприклад, рівновага реакції розкладу карбонату кальцію
CaCO3 Û CaO + CO2 – 178 кДж
При підвищенні температури зміщується вправо (DH = 178 кДж/моль), а рівновага реакції розкладу нітроген монооксиду
2NO Û N2 + O2 + 181 кДж
зміщується вліво (DH = -181 кДж/моль).
Значення принципу ле Шательє в хімії дуже велике, оскільки він дає можливість передбачити напрямок реакції за різних умов, і, отже, керувати протіканням реакцій.
Контрольні завдання
2.1. Що таке внутрішня енергія замкненої системи?
Який взаємозв’язок між внутрішньою енергією роботою і теплотою для ізобарного і ізохорного процесів?
2.2. Обчисліть, яка кількість теплоти виділиться при відновлені Fe2O3 металічним алюмінієм, якщо було одержано 33,5г. заліза.
2.3. Сформулюйте закон Геса і обчисліть тепловий ефект реакцій розладу 560 дм3, аміаку, якщо термохімічне рівняння має вигляд:
3 H2+N2=2NH3; 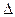 H0xp = -92,4кДж.
H0xp = -92,4кДж.
2.4. Для одержання заліза із його оксиду /III/ використовують термічний метод. В чому його сутність? Обчисліть тепловий ефект цієї реакції, яка протікає в стандартних умовах.
2.5. Газоподібний етиловий спирт C2H5OH можна одержати при взаємодії етилену C2H4 (r) і водяних парів. Напишіть термохімічне рівняння цієї реакції, обчисліть її тепловий ефект.
2.6. Під час пропускання водяного пару над розжареним вуглем утворюється водень і оксид вуглецю /II/. Обчисліть тепловий ефект реакції і кількість теплоти, яка поглинається 10кг вугля.
2.7. Обчисліть 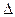 H 0288 реакції CaO(k)+ SiO2(k) = Ca Si O3.
H 0288 реакції CaO(k)+ SiO2(k) = Ca Si O3.
Яка це реакція – екзот – або ендотермічна?
2.8. Етиловий спирт може бути використаний в якості палива.
Складіть термохімічне рівняння реакції горіння і обчисліть теплоту утворення спирту,
якщо при згоранні 11,5г. його 308,7 кДж теплоти.
2.9. Напишіть термохімічне рівняння реакції між CO(r) і воднем, в результаті якої утворюються CH4 (r) і H2O(r).
Скільки теплоти виділиться при цій реакції якщо було використано 67,2 л. метану в перерахунку на нормальні умови?
2.10. Кристалічний хлорид амонію утворюється при взаємодії аміаку і хлороводню. Напишіть термохімічне рівняння цієї реакції обчисливши її тепловий ефект. Скільки теплоти виділиться, якщо в реакції було використано 10 л. аміаку в перерахунку на нормальні умови?
2.11. Тепловий ефект реакції згорання рідкого бензолу з утворенням парів води і діоксиду вуглецю дорівнює 3135,58 кДж. Складіть термохімічне рівняння цієї реакції і обчисліть теплоту утворення.
2.12. Обчисліть скільки теплоти виділиться при згоранні 165 л. /н.у./ ацетилену C2H2, якщо продуктами згорання діоксид вуглецю і пари води?
2.13. При згоранні газоподібного аміаку утворюються пари води ы оксид азоту. Скыльки теплоти виділиться при цій реакції, якщо було одержано 44,8 л. NO / при н.у. /?
2.14. Гідроксид калію розчиняють у воді. На руйнування кристалічної решітки 1 моля KOH потребується 790,5 кДж теплоти, а при гідратацій іонів K+ i OH- виділяється відповідно – 338,9 і -510,5 кДж теплоти. Обчисліть тепловий ефект розчинення KOH
2.15. При згоранні 11,5 г. рідкого етилового спирту виділилось 308,71 кДж теплоти. Напишіть термохімічне рівняння реакції, в результаті якої утворюються пари води і діоксид вуглецю. Обчисліть теплоту утворення C2 H5OH(ж).
2.16. При взаємодії 6,3 заліза з сіркою виділилось 11,31 кДж теплоти. Обчисліть теплоту утворення сульфіда заліза FeS.
2.17. При згоранні 1 л. ацетилену /н.у./ виділяється 56,053 кДж теплоти. Напишіть термохімічне рівняння реакції в результаті якої утворюються пари води і діоксид вуглецю. Обчисліть теплоту утворення C2H2(r).
2.18. При одержанні еквівалентної маси гідроксиду кальцію із CaO(r) і H2O(ж) виділяється 32,53 кДж теплоти. Напишіть термохімічне рівняння цієї реакції і обчисліть теплоту утворення оксиду кальцію.
2.19. Який вплив на ентропійний фактор реакції чинить температура? Обчисліть 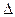 S0298 реакції термічного розкладу карбонату кальцію.
S0298 реакції термічного розкладу карбонату кальцію.
2.20. Обчисліть 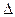 H0298 і
H0298 і 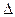 S0298 реакції одержання заліза із оксиду заліза /II/, якщо в якості відновника використовується оксид вуглецю /II/.
S0298 реакції одержання заліза із оксиду заліза /II/, якщо в якості відновника використовується оксид вуглецю /II/.
2.21. Обчисліть 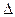 G0298 для реакції NH4Cl(k)=NH3 (r) + HCl(r). чи можливе самовідновлення протікання цього процесу при стандартних умовах. Як впливає температура на константу рівноваги цього процесу?
G0298 для реакції NH4Cl(k)=NH3 (r) + HCl(r). чи можливе самовідновлення протікання цього процесу при стандартних умовах. Як впливає температура на константу рівноваги цього процесу?
2.22. Виходячи із аналізу 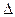 G0298 екзотермічної реакції
G0298 екзотермічної реакції
2KClO3(k)=2KCl(k)+3O2(r),
обґрунтуйте можливості її самодовільного протікання в стандартних умовах.
2.23.Розрахуйте зміну енергії Гібса для реакції при 298 К
NO(r)+1/2 O2(r) =NO2(r)
якщо 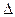 H 0298 = -57,3 кДж і
H 0298 = -57,3 кДж і 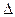 S0298 =-72,9 Дж/к.
S0298 =-72,9 Дж/к.
Як із реакцій – пряма чи оборотна – більш імовірна?
2.24.Обчисліть 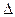 G0298 реакції термічного розладу (NH4)2Cr2O7, виходячи із значень
G0298 реакції термічного розладу (NH4)2Cr2O7, виходячи із значень
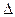 H0298 і
H0298 і 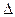 S0298 аміаку і оксиду хрома /III/.
S0298 аміаку і оксиду хрома /III/.
2.25. Обчисліть 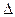 H0298,
H0298, 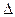 S0298 і
S0298 і 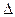 G0298 реакції окислення киснем оксидів кальцію і барію
G0298 реакції окислення киснем оксидів кальцію і барію
до їх пероксидів. Утворення якого з пероксидів CaO2 або BaO2 більш імовірно?
2.26. Стандартний тепловий ефект реакції
2CuO(k)=CuO(k)+1/2O2 на моль Cu2O дорівнює 163,2 кДж/моль. Розрахуйте стандартну теплоту утворення Cu2O(k).
2.27. У скільки разів зміниться швидкість прямої і обортної реакції в системі 2A (r) + B(r) 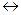 2AB(r), якщо концентрація А і В збільшили, а концентрацію АВ зменшили в три рази?
2AB(r), якщо концентрація А і В збільшили, а концентрацію АВ зменшили в три рази?
2.28. Тиск в системі CO2(r)+C(rв) 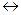 2CO(r) збільшили в три рази. В скільки разів зміняться швидкості прямої і оборотної реакції.
2CO(r) збільшили в три рази. В скільки разів зміняться швидкості прямої і оборотної реакції.
2.29. На скільки градусів необхідно збільшити температуру в системі A+B 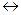 AВ, щоб швидкість прямої реакції збільшилась в 16 разів? /температурний коефіцієнт дорівнює 2/.
AВ, щоб швидкість прямої реакції збільшилась в 16 разів? /температурний коефіцієнт дорівнює 2/.
2.30. При збільшені температури на 200 С швидкість прямої реакції збільшилась в чотири рази, а оборотний в 6,25 рази. Визначте температурні коефіцієнти прямої і оборотної реакції.
2.31. Як зміниться швидкість оборотної реакції в системі N2O4(r) 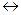 2NO2(r) якщо концентрація NO2 зменшили в два рази, а температуру знизили на 300 С? Температурний коефіцієнт швидкості оборотної реакції дорівнює 2.
2NO2(r) якщо концентрація NO2 зменшили в два рази, а температуру знизили на 300 С? Температурний коефіцієнт швидкості оборотної реакції дорівнює 2.
2.32. Об’єм системи CO(r)+Cl2(r) 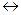 COCl2(r) збільшили в три рази і одночасно температуру знизили на 200С. Як зміниться швидкість прямої реакції?. Температурний коефіцієнт дорівнює 2.
COCl2(r) збільшили в три рази і одночасно температуру знизили на 200С. Як зміниться швидкість прямої реакції?. Температурний коефіцієнт дорівнює 2.
2.33. Вихідна суміш складається із 0,30 моль/л H2 і 0,20 моль/л N2. Рівновага наступить, коли прореагує 0,24 моль/л H2. Обчисліть константу рівноваги.
2.34. При синтезі аміаку 3H2(r) +N2(r) 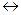 2NH3(r) рівновазі знаходяться 0,1 моль /дм3 N2, 0,2 моль/дм3 H2 і 0,8 моль/дм3 NH3... Обчисліть константу рівноваги і розрахуйте вихідні концентрації азоту і водню.
2NH3(r) рівновазі знаходяться 0,1 моль /дм3 N2, 0,2 моль/дм3 H2 і 0,8 моль/дм3 NH3... Обчисліть константу рівноваги і розрахуйте вихідні концентрації азоту і водню.
2.35. В скільки разів зміниться швидкість прямої реакції 2A+B 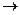 C, якщо концентрація речовини А збільшити в два рази, а концентрацію речовини В зменшити в два рази?
C, якщо концентрація речовини А збільшити в два рази, а концентрацію речовини В зменшити в два рази?
2.36. Реакція протікає за рівнянням 2NO+O2 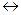 2NO2. Концентрація вихідних речовин, моль/дм3
2NO2. Концентрація вихідних речовин, моль/дм3  =0,03;
=0,03; 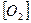 =0,05. Як зміниться швидкість реакції, якщо збільшити концентрації кисню 0,10, NO до 0,06 моль/дм3?
=0,05. Як зміниться швидкість реакції, якщо збільшити концентрації кисню 0,10, NO до 0,06 моль/дм3?
2.37. Напишіть вираз N2+3H2 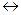 2HN2 для константи рівноваги гомогенної системи: Як зміниться швидкість прямої реакції утворення аміаку, якщо збільшити концентрацію водню в три рази?
2HN2 для константи рівноваги гомогенної системи: Як зміниться швидкість прямої реакції утворення аміаку, якщо збільшити концентрацію водню в три рази?
2.38. Розрахуйте, як зміниться швидкості прямої і оборотної реакції в системі 2SO2+O2 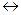 2SO3, якщо зменшити об’єм, який займають гази в два рази?
2SO3, якщо зменшити об’єм, який займають гази в два рази?
2.39. Екзотермічна реакція утворення води протікає за рівнянням: H2(r) +1/2O2(r) 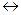 H2O(ж),
H2O(ж), 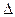 H= - 285,84 кДж/ моль.
H= - 285,84 кДж/ моль.
Як треба змінити температуру, тиск, концентрацію, щоб змістити рівновагу в сторону прямої реакції утворення води?
2.40. Напишіть вираз для константи рівноваги гомогенної системи 2SO2+O2 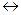 2SO3. Як зміниться швидкість прямої реакції – утворення оксиду сірки /VI/, якщо збільшити концентрацію SO2 в три рази?
2SO3. Як зміниться швидкість прямої реакції – утворення оксиду сірки /VI/, якщо збільшити концентрацію SO2 в три рази?
2.41. Напишіть вираз для константи рівноваги в системі CO+2H2 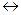 CH3OH. Як зміниться швидкість прямої реакції, якщо парціальний тиск водню збільшити в три рази?
CH3OH. Як зміниться швидкість прямої реакції, якщо парціальний тиск водню збільшити в три рази?
2.42. Реакція йде за рівнянням H2+I2=2HI, константа швидкості цієї реакції при деякі температурі дорівнює 0,16. Вихідні концентрації реагуючих речовин моль/л CH2= 0,04; Ci2= 0,05. Обчисліть початкову швидкість реакції і її швидкість, якщо CH2 складає 0,03 моль/л.
2.43. Обчисліть в скільки разів зменшиться швидкість реакції, яка протікає в газові фазі, якщо знизити температуру від 320 до 280 К. Температура коефіцієнт реакції 3.
2.44. Як зміниться швидкість реакції, яка протікає в газовій фазі, при підвищенні температури на 60К, якщо температурний коефіцієнт швидкості даної реакції 25?
2.45. Обчисліть константу рівноваги гомогенної системи CO+H2O 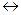 CO2+H2, якщо рівноважні концентрації, моль/дм3;
CO2+H2, якщо рівноважні концентрації, моль/дм3; 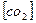 = 0,016;
= 0,016; 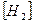 =0,016. Чому дорівнюють вихідні концентрації води і моно оксиду вуглецю?
=0,016. Чому дорівнюють вихідні концентрації води і моно оксиду вуглецю?
2.46. В скільки разів зменшиться швидкість реакції, яка протікає при 298 К, якщо енергія активації її збільшиться на 30кДж/моль?
2.47. При змінені температури на 30 К швидкість реакції зросла в десять разів. Обчисліть значення енергії активації реакції.
2.48. Визначте значення енергії для реакції, яка йде в газові фазі, якщо при підвищенні температури від 290 до 310 К швидкість її збільшується в два рази.
2.49. При підвищенні температури на 100С швидкість хімічної реакції зростає в 2 рази. При 200С вона дорівнює 0,04 моль/л.г. Яка буде швидкість цієї реакції при: а/400С, б/100С, в/00С?
2.50. При 200С швидкість хімічної реакції дорівнює 0,01 моль/л.г. Яка вона буде при: а/00С, б/600С, якщо при підвищенні температури на 100С вона зростає в 3 рази?
МОДУЛЬ 3
Розчини, як багатокомпонентні системи. Фізична та хімічна теорії розчинів.
Розчинами називаються гомогенні (однорідна) термодинамічно стійкі системи, які складаються із двох або більше компонентів: розчинника, розчинених речовин і продуктів їх взаємодії. Розчини бувають тверді (сплави металів), рідкі і газоподібні (повітря). Найбільш практичне значення мають рідкі розчини, оскільки в них протікає більшість реакцій.
Процес утворення розчину має проміжну природу між фізичною і хімічною. Оскільки розчини не мають сталого складу і до них не можна застосозчини наближаються до механічних сумішей. Однорідність, значні об’ємні і енергетичні ефекти, що супроводжують процес розчинення багатьох речовин, наближають розчини до хімічних сполук.
Розчинник - рідка речовина, в якій розчиняються інші речовини. Розчинником може бути будь-яка рідина: вода, спирт, бензол і ін. Частіше всього в якості розчинника використовується вода.
Розчинена речовина - речовина, яка розчинилася в данному об’ємі (або масі) розчинника.
Процес переходу речовини, яку розчиняють, в товщу розчинника називається розчиненням. Якщо процес розчинення відбувається з поглинанням теплоти (ендотермічний, DH>0), то згідно з загальним термодинамічним рівнянням DG=DH-TDS, ентропія системи зростає, тобто DS>0. Якщо ж процес розчинення відбувається з виділенням теплоти (екзотермічний, DH<0), то згідно з тим самим рівнянням, можливі два випадки: DS>0 і DS<0. Ці явища, пов¢язані з тепловими ефектами процесу розчинення, а також деякі інші вказують на хімічну взаємодію розчиненої речовини з розчинником. Це було встановлено у 80-х роках минулого століття Д.І.Менделєєвим, який розробив гідратну теорію, згідно з якою під час утворення розчинів відбуваються не тільки фізичні, але й хімічні процеси.
(2)
Теорія сольватації Д.І.Менделєєва. Гідратація.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3413; Нарушение авторских прав?; Мы поможем в написании вашей работы!