
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярних орбіталей
|
|
|
|
Згідно з методом валентних зв’язків, усі ковалентні зв’язки, що виникають між атомами, зумовлені наявністю спільної пари електронів. Метод валентних зв’язків має як позитивні, так і негативні сторони. Так, він пояснює здатність атомів утворювати чітко визначене число ковалентних зв’язків, дозволяє задовільно описувати структуру і властивості багатьох молекул, але в деяких випадках цим методом неможливо пояснити природу хімічних зв’язків або ж можна дійти неправильних висновків про властивості молекул.
Основна причина цього, мабуть, полягає в тому, що висновки, яких дійшли В.Гейтлер і Ф.Лондон під час розрахунку молекули водню, справедливі тільки для 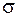 -зв’язків і не справджуються для
-зв’язків і не справджуються для 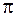 -зв’язків. Цих недоліків методу валентних зв’язків майже позбавлений метод молекулярних орбіталей (метод МО), який почали розробляти у 30-х роках нашого століття Р.С.Малікен, Ф.Гунд, Е.Хюккель.
-зв’язків. Цих недоліків методу валентних зв’язків майже позбавлений метод молекулярних орбіталей (метод МО), який почали розробляти у 30-х роках нашого століття Р.С.Малікен, Ф.Гунд, Е.Хюккель.
Згідно з методом МО, молекула або комплекс розглядаються як єдине ціле. Метод молекулярних орбіталей виходить з припущення, що під час утворення молекул атомні орбіталі електронів, які не утворюють хімічних зв’язків, а також ті, що беруть в них безпосередню участь, не залишаються незмінними, а перетворюються в нові молекулярні орбіталі. Кожній молекулярній орбіталі відповідає певний набір молекулярних чисел; для молекул залишається справедливим принцип Паулі: на кожній молекулярній орбіталі може знаходитись не більше двох електронів з протилежно напрямленими спінами.
Отже, метод МО грунтується на таких положеннях:
1. Кожний електрон у молекулі характеризується певною хвильовою функцією 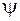 , яка визначає орбіталь електрона і називається молекулярною орбіталлю.
, яка визначає орбіталь електрона і називається молекулярною орбіталлю.
2. На відміну від одноцентрових АО молекулярна орбіталь дво- або багатоцентрова; електронна хмара одночасно належить кільком атомним ядрам.
3. Форма хвильової функції та енергія відповідного рівня (стан електронів у молекулі) визначаються чотирма молекулярними квантовими числами n, l, 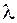 , ms. Два перших квантових числа n i l мають такі самі особливості, що й головне і побічне квантові числа для АО; вони набувають таких значень: n=1,2,3,4,...,n; l=0,1,2,3,..., n-1.
, ms. Два перших квантових числа n i l мають такі самі особливості, що й головне і побічне квантові числа для АО; вони набувають таких значень: n=1,2,3,4,...,n; l=0,1,2,3,..., n-1.
Молекулярне квантове число 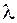 може мати значення 0,
може мати значення 0, 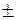 1,
1, 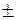 2,
2, 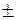 3,...,
3,..., 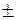 n-1, воно подібне до магнітного квантового числа і характеризує розташування МО відносно атомних ядер. Додатньому і від’ємному значенням
n-1, воно подібне до магнітного квантового числа і характеризує розташування МО відносно атомних ядер. Додатньому і від’ємному значенням 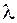 відповідають дві аналогічні молекулярні орбіталі, одна з яких розташована нижче, а друга вище від осі, що сполучає ядра атомів.
відповідають дві аналогічні молекулярні орбіталі, одна з яких розташована нижче, а друга вище від осі, що сполучає ядра атомів.
Різні МО характеризуються певними значеннями 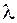 , що мають також буквені позначення, як і типи АO (s,p,d,f):
, що мають також буквені позначення, як і типи АO (s,p,d,f): 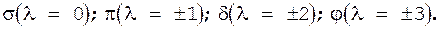 При цьому зазначають атомні орбіталі, з яких утворена МО, враховуючи, що
При цьому зазначають атомні орбіталі, з яких утворена МО, враховуючи, що 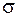 -зв’язки виникають внаслідок перекривання s-та px-орбіталей.
-зв’язки виникають внаслідок перекривання s-та px-орбіталей.
Четверте молекулярне квантове число ms характеризує момент власного руху електрона і здатне набувати тільки двох значень. Отже, МО не може містити більше, ніж два електрони.
4. Електрони заповнюють МО згідно з принципом Паулі і правилом Гунда в міру підвищення їх енергетичного рівня.
Метод молекулярних орбіталей для знаходження хвильових функцій, що описують стан електронів на молекулярних орбіталях, вводять ряд припущень. Так, вважають, що орбіталь електрона при його зближенні з якимось одним ядром піддається дії тільки цього ядра. Отже, хвильва функція в полі одного ядра нагадує хвильове рівняння для ізольованого атома, а МО поблизу кожного ядра - відповідну АО. Такий підхід до розгляду енергії зв’язку був умовно названий методом лінійних комбінацій атомних орбіталей, або скорочено ЛКАО. За цим методом, хвильова функція 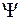 , що відповідає молекулярній орбіталі МО, є лінійною комбінацією (сумою) функцій атомних орбіталей АО і може бути подана у такому вигляді:
, що відповідає молекулярній орбіталі МО, є лінійною комбінацією (сумою) функцій атомних орбіталей АО і може бути подана у такому вигляді: 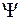 = С1
= С1 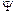 1 +С2
1 +С2 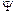 2+ С3
2+ С3 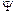 3 +....+Сn
3 +....+Сn 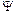 n, де n - кількість атомів у молекулі або комплексі;
n, де n - кількість атомів у молекулі або комплексі; 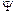 1,
1, 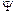 2,
2, 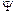 3,
3, 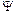 n - хвильові функції електронних орбіталей атомів, що взаємодіють; С1, С2, С3,Сn - певні числові коефіцієнти, які вибираються, виходячи з умов мінімуму енергії.
n - хвильові функції електронних орбіталей атомів, що взаємодіють; С1, С2, С3,Сn - певні числові коефіцієнти, які вибираються, виходячи з умов мінімуму енергії.
Оскільки на молекулярній орбіталі може перебувати як два, так і один електрон, метод МО дає змогу оцінити внесок в хімічний зв’язок не тільки електронних пар, але й окремих електронів. Метод молекулярних орбіталей навіть в його найпростішій формі (метод МО ЛКАО) правильніше описує властивості молекул, ніж метод валентних зв’язків. Особливо це стосується складних молекул, які часто взагалі неможливо описати в рамках методу валентних зв’язків.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 5878; Нарушение авторских прав?; Мы поможем в написании вашей работы!