
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аміни. Будова, ізомерія, класифікація. Методи одержання…
|
|
|
|
Найважливіші алкалоїди маку:морфін,кодеїн,папаверин,наркотин,тебаїн,їх використанняв медицині.Фізіологічна дія на організм людини.Тести швидкого визначення наркотично активних алколоїдів опію.
Морфін є найважливішим опійним алкалоїдом (алкалоїд опійного маку), в опії його міститься 3-20%. Має пентациклічну будову і структурну подібність з деякими іншими природними і синтетичними опіоїдами (зокрема, кодеїном, налбуфіном і налтрексоном). У молекулі дві гідроксильні групи – фенольного і спирт ового характеру, які і зумовлюють його хімічні властивості. Основа морфіну погано розчиняється у воді і порівняно добре в органічних розчинниках, якими він екстрагується з лужних водних розчинів (рН=8,6-10,2).
Дія на організм. Має сильну болезаспокійливу, виражену снодійну та ейфоричну дію. Гальмує умовні рефлекси і підсилює дію наркотичних снодіючих і місцево анестезуючих засобів. Збуджує блювотний центр і знижує збудливість дихального і кашлевого центрів, гальмує рухову і секреторну активність шлунково-кишкового тракту. Знижує основний обмін. Гідрохлорид морфіну використовують у медицині як знеболюючий засіб. Тривале застосування приводить до наркоманії (морфінізму).
Кодеїн - найпоширеніший опійний алкалоїд. Це продукт метилювання морфіну.
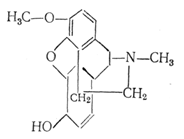
Кодеїн - наркотичний анальгетик і противокашльовий засіб. Він менш токсичний і в меншому ступені викликає звикання, чим морфін. Кристалічний порошок білого кольору або безбарвні кристали. Розчинний у киплячій воді, легко розчинний у 96 %-ному спирті, розчинний в ефірі.
Папаверин – алкалоїд, що міститься в опіумі. Має ізохінолінове ядро, що зєднане з
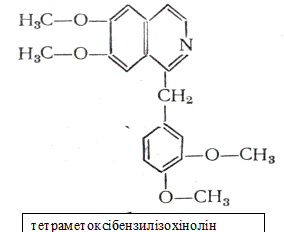
бензиловим радикалом. Кристалічна речовина. Вживається як снодійне.
Наркотин (гноскапин, носкапин) является одним из алкалоидов опия, в котором содержится 0,75—9 % этоговещества. Наркотин легко рацемизируется. При кипячении уксусно-кислых растворов наркотина образуется егорацемат (гноскапин). Природный наркотин является левовращающим. Применение. Действие на организм. Наркотин в чистом виде не применяется в медицине. Однако он входит в состав опия и омнопона, которые являются фармацевтическими препаратами. Наркотин имеет большое токсикологическое значение. Обнаружение его в организме трупов или в биологических жидкостях является одним из доказательств отравления опием или омнопоиом. Наркотин применяется в промышленности для получения котарнина, из которого приготовляют стиптицин.
В отличие от некоторых других алкалоидов опия наркотин не обладает наркотическими и анальгетическими свойствами. Он не вызывает привыкания. По действию наркотин подобен папаверину, однако он более токсичный, чем папаверин.
Тебаїн (Параморфін) - органічна сполука, алкалоїд, що міститься в опіумі. Використовується як сировина для виготовлення лікарських препаратів.
Тебаїн є найменшою складовою частиною опію і він хімічно подібний кодеїну та морфіну, але справляє скоріше збудливий ефект, ніж гальмівний. Тебаїн не вживається терапевтично, але переробляється на різноманітні препарати, включаючи бупренорфін, налбуфін, налоксон, налтрексон, оксикодон, оксиморфон, гідрокодон та кодеїн. Він перебуває у списку №2 переліку наркотичних засобів, психотропних речовин та їх прекурсорів, що підлягають контролю в РФ, також він контролюється багатьма міжнародними законами.
Вміст тебаїну в опіумі: до 0,2 відсотка. Назва виникла імовірно від Тебайского легіону. У терапевтичних цілях тебаїн не використовується. З тебаїну, за допомогою реакції Дільса-Альдера синтезується такі препарати як Бупренорфін, Оксикодон, Налоксон, Налбуфін та Еторфін.
13.Реакції морфіну,кодеїну,героїну.Загальноалкалоїдні реакції на морфін та кодеїн і реакції повязані з функціональними групами цих алкалоїдів.Визначення опіатів методом тонкошарової хроматографії.
| Формула | C17H19NO3 |
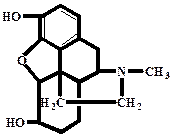
Морфін є найважливішим опійним алкалоїдом (алкалоїд опійного маку), в опії його міститься 3-20%. Має пентациклічну будову і структурну подібність з деякими іншими природними і синтетичними опіоїдами (зокрема, кодеїном, налбуфіном і налтрексоном). У молекулі дві гідроксильні групи – фенольного і спирт ового характеру, які і зумовлюють його хімічні властивості. Основа морфіну погано розчиняється у воді і порівняно добре в органічних розчинниках, якими він екстрагується з лужних водних розчинів (рН=8,6-10,2).
Дія на організм. Має сильну болезаспокійливу, виражену снодійну та ейфоричну дію. Гальмує умовні рефлекси і підсилює дію наркотичних снодіючих і місцево анестезуючих засобів. Збуджує блювотний центр і знижує збудливість дихального і кашлевого центрів, гальмує рухову і секреторну активність шлунково-кишкового тракту. Знижує основний обмін. Гідрохлорид морфіну використовують у медицині як знеболюючий засіб. Тривале застосування приводить до наркоманії (морфінізму).
Кодеїн - найпоширеніший опійний алкалоїд. Це продукт метилювання морфіну.
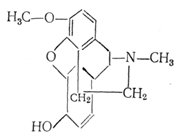
| Формула | C18H21NO3 |
Кодеїн - наркотичний анальгетик і противокашльовий засіб. Він менш токсичний і в меншому ступені викликає звикання, чим морфін.
Героїн (діацетилморфін, діаморфін) — сильнодіючий синтетичний наркотик, похідна морфіну, знеболюючий засіб, пригнічує центральну нервову систему. Білий (або з домішками — світлий сірувато-коричневий) порошок у вигляді дрібних кристаликів з неприємним запахом. Переважно гіркий на смак.
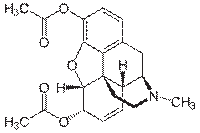
| Молекулярна формула | C21H23NO5 |
31. Емісійна спектроскопія. Теоретичні основи емісійної спектроскопії. Спектральні методи. Якісний і кількісний спектральний аналіз
Спектроскопія – розділи фізики та аналітичної хімії, присвячені вивченню спектрів взаємодії випромінювання (в тому числі, електромагнітного випромінювання, акустичних хвиль та ін.) з речовиною.
Залежно від фізичної природи процесу взаємодії випромінювання з речовиною методи атомної спектроскопії електромагнітного випромінювання (як оптичного, так і рентгенівського діапазону) ділять на емісійні і абсорбційні.
Емісійні методи – засновані на вимірюванні інтенсивності світла, яке випромінює речовина (флюорометрія, емісійний спектральний аналіз, полум’яна фотометрія).
У оптичних емісійних методах для отримання спектру випускання необхідний попередній перехід атомів в збуджений стан. Для цієї мети слугують пристрої, які називають джерелами збудження – джерела високої температури (для оптичних методів), або потоки високоенергетичних частинок (для рентгенівських методів), електромагнітне випромінювання.
Емісійні оптичні методи, в яких збудження атомів відбувається під дією високої температури, називають методами атомно-емісійної спектроскопії (АЕС). В цих методах атомізатор і джерело збудження – один і той же пристрій, що суміщає обидві функції. Якщо джерелом збудження служить електромагнітне випромінювання, методи називають флуоресцентними – атомно-флуоресцентна спектроскопія (АФС), рентгено-флуоресцентний аналіз (РФА).
Метод атомно-емісійної спектроскопії (АЕС) базується на термічному збудженні вільних атомів або одноатомних іонів і реєстрації оптичного спектру випуску збуджених атомів. При цьому інтенсивність випромінювання прямо пропорційна числу збуджених частинок. Оскільки збудження атомів має термічну природу, збуджені і незбуджені атоми знаходяться між собою в термодинамічній рівновазі, стан якої описується законом розподілу Больцмана.
Отже, інтенсивність емісійної спектральної лінії може бути використана як аналітичний сигнал для визначення концентрації елементу. Коефіцієнт в рівнянні є суто емпіричною величиною, залежною від умов процесу. Тому в АЕС вирішальне значення має правильний вибір умов атомізації і вимірювання аналітичного сигналу, включаючи градуювання за зразками порівняння.
У реальних умовах метод атомно-емісійного аналізу простий, а залежність між інтенсивністю і концентрацією, виражена співвідношенням, часто порушується через різноманітні побічні ефекти як оптичної, так і фізико-хімічної природи.
Спектральні методи аналізу - це методи, засновані на визначенні хімічного складу і будови речовин з їх спектру. Спектром речовини називають упорядковане по довжинах хвиль електромагнітне випромінювання, що випускається, що поглинається, розсіюється або переломлюється речовиною.
Розрізнюють атомний і молекулярний, а також якісний і кількісний спектральний аналіз. Атомний спектральний аналіз здійснюють за оптичними і рентгенівськими (пулюєвими) спектрами. Для молекулярного спектрального аналізу використовують молекулярні спектри поглинання в інфрачервоній, видимій та ультрафіолетовій областях спектру. Серед методів спектрального аналізу – атомно-абсорбційний аналіз, атомно-флуоресцентний аналіз, лазерний спектральний аналіз, метод рентгенівської (пулюєвої) флуоресценції, атомний емісійний та інші.
Основою якісного спектрального аналізу є властивість кожного хімічного елемента випромінювати характерний лінійчатий спектр. Отже, якісний аналіз полягає у відшукуванні ліній визначуваного елемента в спектрі проби. Належність ліній даному елементу встановлюється по довжині хвилі та інтенсивності лінії. Однак, загальне число ліній в спектрі багатьох елементів дуже велике: наприклад, спектр торію нараховує більше 2500 ліній, а спектр урану – більше 5000. Немає необхідності, звичайно, визначати довжини хвиль всіх спектральних ліній в спектрі проби. Для цього достатньо лише встановити наявність або відсутність в спектрі так званих аналітичних або останніх ліній.
В практиці кількісного спектрального аналізу зазвичай використовують інтенсивність не окремої лінії, а відношення інтенсивності двох спектральних ліній, які належать різним елементам. Таким чином, в якості властивості, зв’язаної з концентрацією елемента, використовується відношення інтенсивності лінії визначуваного елемента до інтенсивності лінії іншого елемента в тому ж спектрі.
Використовують для кількісного спектрального аналізу рівняння Ломакіна, яке свідчить про те, що відношення інтенсивностей також є пропорційне концентрації елемента в пробі. Це головне рівняння методів кількісного спектрального аналізу. Методи відрізняються тільки способом оцінки відносної інтенсивності.
32. Атомно-адсорбційний спектральний аналіз. Інструментальне оформлення емісійної спектроскопії
Абсорбційні методи засновані на вимірюванні випромінювання, яке поглинуто речовиною (колориметрія, фотоколориметрія, спектрофотометрія, атомно-абсорбційний аналіз).
Метод атомно-абсорбційного аналізу (запропонував у 1955 році Уолш) базується на поглинанні вільними атомами резонансного випромінювання при пропусканні променя світла через шар атомної пари. Селективно поглинається світло на частоті резонансного переходу атома. Атоми переходять з основного стану у збуджений, а інтенсивність променя світла, що пройшов зменшується. При поглинанні кванта світла вільний атом переходить в збуджений стан. Таким чином, необхідна попередня атомізація проби. Аналітичний сигнал формують незбуджені атоми. Величина оптичної густини атомної пари відповідно до основного закону світлопоглинання прямопропорційна концентрації поглинаючих частинок – атомів визначуваного елементу в атомізаторі.
Найбільш імовірною зміною енергетичного стану атома при збудженні є перехід на рівень, найближчий до основного енергетичного стану, тобто резонансний перехід. Якщо на незбуджений атом направити випромінювання з частотою, рівною частоті резонансного переходу, кванти світла будуть поглинатися атомами й інтенсивність випромінювання буде зменшуватися. Використання цього явища і лягло в основу атомно-абсорбційної спектроскопії.
Таким чином, якщо в емісійній спектроскопії концентрація речовини пов’язана з інтенсивністю випромінювання, яке було прямо пропорційне числу збуджених атомів, то в атомно-абсорбційній спектроскопії аналітичний сигнал (зменшення інтенсивності випромінювання або оптична густина) пов’язаний із числом незбуджених атомів.
Джерело випромінювання – лампа з порожнистим катодом, що містить визначуваний елемент. Ця лампа є скляним балоном з катодом у вигляді стаканчика чи циліндра, виготовленого з необхідного металу чи сплаву, анодом і віконцем для виходу виходу променя. Лампа заповнена інертним газом (аргон, неон при тиску 100 Па). При подачі на електроди напруги ~ 300 В в лампі виникає тліючий розряд, причому він локалізується в порожнині катоду. Іони інертного газу бомбардують катод, вибиваючи атоми металу і розпилюючи їх. Атоми металу збуджуються в газовому розряді через зіткнення з іонами і електронами інертного газу. В результаті лампа вилучає емісійний спектр необхідного елемента.
Для того, щоб атоми випромінювання енергію, необхідно перевести їх з нормального стану в збудження. В спектральному аналізі для цього використовують полум’я, дугу або іскру(або інше джерело), тобто застосовуються термічні джерела збудження. При цьому розподіл атомів по ступенях збудження визначається законом Больцмана:
Ni = No * gi /go *e-Ei / kT,
де No і Ni – концентрації нормальних і збуджених(до рівня і) атомів;
Ei – енергія збудження і-го рівня;
gi і go – статистичні ваги збудженого і нормального станів;
k – стала Больцмана(k=1,38*10-23Дж/К);
Т – температура, К.
Підставляючи значення Ni у формулу для інтенсивності спектральної лінії, отримуємо:
Іin = No * Ain * gi / go * h * n * e-Ei / kT.
Таким чином, інтенсивність спектральної лінії буде залежати не тільки від електронної будови атома, але і від температури джерела випромінювання. Тому в атомно-емісійному спектральному аналізі прийнято вимірювати інтенсивність аналітичної лінії відносно інтенсивності деякої лінії порівняння(внутрішній стандарт). Частіше всього – це лінія, яка належить основному компоненту проби. Інколи компонент, який відіграє роль внутрішнього стандарту, спеціально вводять в аналізовану пробу.
15.Похідні амфетаміна.Будова і властивості амфетаміна та метамфетамінаТести швидкого визначення.
Амфетаміни - це речовини, що відносяться до психостимуляторів, тобто викликають збудження знижують потребу в сні та посилення активності нервової системи, чим і обумовлено відчуття ейфорії при прийомі цих наркотичних засобів, проте при зловживанні призводять до головних болів, депресії, психозу та інших психічних розладів. Викликають сильну психічну залежність.
Амфетаміни - клас сполук, що включає власне амфетамін і його похідні: метамфетамін, ефедрин, катинон, меткатинон, 3,4-метилендіоксіамфетамін (MDA), 3,4-метілендіоксиметамфетамін (MDMA, «Екстазі»), 2,5-диметокси-4-бромоамфетамін (DOB).
Метамфетамін або МЕТ - це білий кристалічний наркотик.
Приймають метамфетамін ін'єкціями, вдихають (інгаляції через ніс), або курять. Метамфетамін також вживають орально, але будь-який спосіб розвиває однаково сильну пристрасть. Метамфетамін викликає помилкове відчуття щастя й успіху, приливу впевненості, гіперактивності та енергії. Вони тривають зазвичай від 6 до 8 годин, але можуть тривати до 24 годин
16.Діазепам та інші похідні бензодіазепіну.Будава діазепама та бензодіазепінів.Застосування в медицині.Фізіологічна дія на організм людини.
Діазепам— лікарський засіб, що відноситься до транквілізаторів з групи похідних бензодіазепіну,що має анксіолітичну, протисудомну, міорелаксуючу та снодійну дію, та застосовується перорально та парентерально.
Бензодіазепіни (2-аміно-1 4-бензодіазепін-4-оксид) — клас психоактивних речовин із снодійним, седативним, анксіолітичним (зменшення тривожності), міорелаксуючим і протисудомним ефектами. Більшість бензодіазепінів є транквілізаторами, деякі використовуються як снодійні засоби. У більшій чи меншій мірі бензодіазепінам притаманна протисудомна дія, деякі з них використовують виключно для боротьби з епілепсією. Бензодіазепіни входять в широку групу речовин депресантів центральної нервової системи. Їх застосовують для лікування і зняття симптомів психічних занепокоєнь, безсоння, збудження, епілептичних припадків, м'язових спазмів, а також абстинентного синдрому від прийому алкоголю та наркотиків. Відома ефективність бензодіазепінів для лікування панічних атак, викликаних прийомом наркотиків-галюциногенів. При довготривалому використанні можуть викликати звикання і фізичну залежність.
похідні бензодіазепіну можна умовно розташувати в такому порядку: феназепам —> нітразепам —> лоразепам —> хлозепід — діазепам —> оксазепам.
Похідні бензодіазепіну збільшують загальну тривалість сну, головним чином, за рахунок значного збільшення тривалості III стадії (поверховий сон) і скорочення періоду засинання. Феномен віддачі (компенсаторне збільшення тривалості швидкого сну) після відміни транквілізаторів менш виражений, але може зберігатися протягом п'яти тижнів.
19. метадон і пов'язані з ним наркотики. будова метадону. його дія на організм людини.
Метадон — синтетичний наркотик опійної групи. В Україні використовується в замістній підтримуючій терапії, як засіб для лікування Наркоманії. Спочатку був введенний для ВІЛ\позитивних пацієнтів. Зараз отримують всі залежні, за власним бажанням. Засіб не дуже токсичний, в порівнянні з героїном, в багатьох країнах заборонений через високу смертність. Так як досить часто його змішують з іншими речовинами.
У зв'язку з тривалим періодом напіввиведення і сильним наркотичним ефектом препарату, передозування дуже небезпечне. Проявляється загальмованістю, сонливістю зниження частоти дихання, аж до повної зупинки дихання. В той же час, якщо людину розбудити, вона може бути в свідомості. Як і при вживанні інших опіоїдів, зіниці вузькі(міоз) - розміром з "макове зернятко" - менше 2,5 мм в діаметрі при звичайному освітленні і 2 мм при прямому світлі. На світло не реагують взагалі або дуже погано. Сечовиділення утруднене. У важких випадках кома, зниження тиску, некардіогенний набряк легень, зупинка серця. Дуже часто будучи без свідомості, можлива попадання блювотних мас в дихальні шляхи з наступною смертю або, якщо людина виживає, розвивається пневмонія.
Молекулярна формула C21H27NO
20. метаквалон. особливості його будови. метаквалон як депрессант
метаквалон у великих дозах дуже токсичний, особливо в комбінації з алкоголем. Залежність від метаквалону швидко розвивається при симптомах абстиненції, які викликаються алкоголем та барбітуратами.
Дія
Застосовують при порушеннях сну різної етіології, у тому числі при безсонні, пов'язаної з гострими та хронічними болями, створює також помірну протисудомну дію. Підсилює дію барбітуратів, аналгетиків, нейролептиків. Володіє противокашлевою активністю, підсилює діюкодеїну. Швидко всмоктується в шлунково-кишковому тракті та майже повністю розщеплюється в печінці. Спостерігається велика подібність у своїй дії до метаквалону та інших депресантів, таких як алкоголь. За снодійним ефектом не поступається барбітуратам. Сон настає через 15-30 хвилин після прийому всередину і триває 6-8 годин.
Залежно від дозування, метаквалон покращує статеві функції, але не у всіх: деякі відчувають розгальмованість та підвищення сексуальної функції, а в інших сексуальна активність знижується.
Препарат звичайно добре переноситься. У рідкісних випадках спостерігаються блювання та інші диспептичні явища. Передозування від метаквалону набагато складніше лікується, ніж передозування від барбітурату, і, крім того, дуже часто призводить до летального результату. У кожному разі, недоліки метаквалону та інших небарбітуратних заспокійливих препаратів перевершують практичні переваги, і в даний час ці препарати не використовуються для допомоги при безсонні та тривожному стані.
Аміни — похідні амоніаку, що утворюються в результаті заміщення атомів Гідрогену на вуглеводневі радикали.
Залежно від числа радикалів розрізняють аміни:
• первинні (R - NH2);
• вторинні (R - NH - R');
• третинні 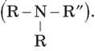
Номенклатура
Складаючи назву, перелічують радикали з додаванням закінчення -амін:
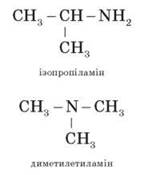
Ізомерія
1) Ізомерія карбонового скелета (починаючи з бутиламіну).
2) Ізомерія положення аміногрупи (починаючи з пропіламіну).
Фізичні властивості
За звичайної температури лише нижчі аліфатичні аміни CH3NH2, (CH3)2NH і (CH3)3N — гази (із запахом амоніаку), середні гомологи — рідини (з різким рибним запахом), вищі — тверді речовини без запаху. Ароматичні аміни — безбарвні рідини з високою температурою кипіння або тверді речовини. Нижчі аміни добре розчинні у воді й мають різкий запах. Зі збільшенням молекулярної маси збільшуються температури кипіння і плавлення, зменшується розчинність у воді.
Зв’язок N - H є полярним, тому первинні та вторинні аміни утворюють міжмолекулярні водневі зв’язки (трохи більш слабкі, ніж Н-зв’язки за участі групи O - H).
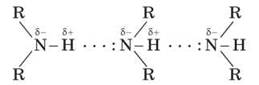
Асоціації амінів
Це пояснює відносно високу температуру кипіння амінів порівняно з неполярними сполуками з подібною молекулярною масою. Наприклад:
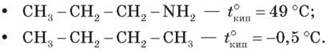
Третинні аміни не утворюють водневих зв’язків, що створюють асоціації (відсутня група N - H). Тому їхні температури кипіння нижчі, ніж в ізомерних первинних і вторинних амінів (триетиламін кипить за температури 89 °С, а н-гексиламін — за 133 °С). Порівняно зі спиртами аліфатичні аміни мають нижчі температури кипіння (t°кип метиламіну - -6 °С, t°кип метанолу - +64,5 °С). Це свідчить про те, що аміни асоційовані меншою мірою, ніж спирти, оскільки міцність водневих зв’язків з атомом Нітрогену менша, ніж за участі більш електронегативного Оксигену.
Аміни здатні до утворення водневих зв’язків з водою:
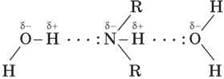
Гідратація амінів
Завдяки цій особливості нижчі аміни добре розчиняються у воді. Зі збільшенням числа й розмірів вуглеводневих радикалів розчинність амінів у воді зменшується, тому що збільшуються просторові перешкоди утворенню водневих зв’язків. Ароматичні аміни у воді практично не розчиняються.
Хімічні властивості амінів
Горіння
Аміни згоряють у кисні, утворюючи азот, вуглекислий газ і воду.
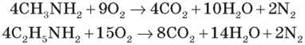
Оскільки аміни є похідними амоніаку й мають подібну з ним будову, вони проявляють властивості, подібні до його властивостей.
Властивості амінів як основ (акцепторів протонів)
Водні розчини аліфатичних амінів дають лужну реакцію, тому що внаслідок їх взаємодії з водою утворюються гідроксиди алкіламонію, аналогічні амоній гідроксиду:
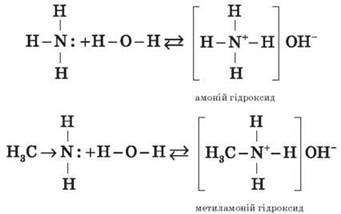
Зв’язок протона з аміном, як і з амоніаком, утворюється за донорно-акцепторним механізмом за рахунок неподіленої електронної пари атома Нітрогену.
Аліфатичні аміни — сильніші основи, ніж амоніак, оскільки алкільні радикали збільшують електронну густину на атомі Нітрогену. З цієї причини електронна пара атома Нітрогену утримується менш міцно й легше взаємодіє з протоном.
Взаємодія з кислотами
Взаємодіючи з кислотами, аміни утворюють солі:
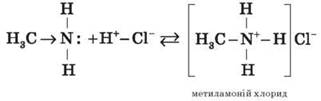
Солі амінів — тверді речовини, добре розчинні у воді. Унаслідок нагрівання лугу витісняють із них аміни:
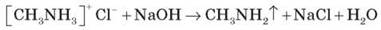
Отже, головні властивості змінюються в ряду:
NH3 < RNH2 < R2NH < R3N (у газовій фазі)
Застосування амінів
Аміни використовують для одержання лікарських речовин, барвників і вихідних продуктів для органічного синтезу. Гексаметилендіамін у процесі поліконденсації з адипіновою кислотою дає поліамідні волокна.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3742; Нарушение авторских прав?; Мы поможем в написании вашей работы!