
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Іонні рівняння
|
|
|
|
Реакції обміну в розчинах електролітів.
З точки зору теорії електролітичної дисоціації у водних розчинах протікають реакції не між самими електролітами, а між утвореними іонами.
При реакціях між іонами, в розчинах електролітів можливі такі випадки: 1) утворені речовини – сильні електроліти, добре розчинні у воді і повністю дисоційовані на іони; 2) одна із утворених речовин – осад, газ, слабкий електроліт (розчинний у воді), або комплексний іон. Розглянемо конкретні приклади.
Реакції в розчинах електролітів, при яких складові частини (іони) однієї речовини обмінюються складовими частинами другої, називають іонообмінними або обмінними реакціями.
Напрямок протікання іоннообмінних реакцій визначається привилом: реакції обміну в розчинах електрролітів протікають практично необоротньо і до кінця в тих випадках, коли в якості продуктів одержуються осади (малорозчинні речовини), слабкі електроліти (малодисоційовані сполуки) і комплексні іони (також малодисоційовані). В тому випадку, коли при взаємодії розчинів електролітів не утворюється ні одна із вказаних сполук, це означає, що хімічна взаємодія практично не відбувається.
Розглянемо приклади.
1. Реакція між розчинами нітрата калія і хлорида натрія (сильні електроліти) в молекулярній формі виразиться рівнянням:
KNO3 + NaCl  KCl + NaNO3
KCl + NaNO3
В розчині до і після змішування солей знаходяться тільки іони К+, NO3-, Na+, Cl-. Оскільки не утворюються нерозчинні сполуки, слабодисоційовані речовини і гази, хімічна взаємодія не відбувається.
2. Прикладом реакції, яка протікає з утворенням газа, може бути взаємодія сульфіда натрія з соляною кислотою:
Na2S + 2HCl  H2S + 2NaCl (молекулярне рівнняння)
H2S + 2NaCl (молекулярне рівнняння)
2Na++ S2-+2H++2Cl-  H2S
H2S 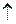 + 2Na+ + 2Cl-(іонно-молекулярне рівняння)
+ 2Na+ + 2Cl-(іонно-молекулярне рівняння) 
S2-+2H+  H2S
H2S 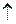 (скорочене іонно-молекулярне рівняння).
(скорочене іонно-молекулярне рівняння).
3. В якості прикладу реакції з утворенням слабкодисоційованої речовини можна навести приклад нейтралізації сильної кислоти лугом:
HCl + NaOH  H2O + NaCl
H2O + NaCl
H+ + Cl- + Na+ + OH-  H2O + Na+ + Cl-
H2O + Na+ + Cl-
H+ + OH-  H2O
H2O 
4. Реакцією з утворенням комплексного іону, наприклад, є одержання комплексного кстіону тетраамін міді (ІІ) при дії аміаку на хлорид міді:
CuCl2 + 4NH3  [Cu(NH3)4]2+ + 2Cl-.
[Cu(NH3)4]2+ + 2Cl-.
Утворені в результаті реакції осад, газ, слабкий електроліт або комплексний іон виділяються із сфери реакції і тому реакція не може протікати в зворотньому напрямку, тобто вона протікає до кінця.
Гідроліз – хімічна взаємодія солей з водою, яке приводить до утворення слабкого електроліту.
Якщо розглядати солі як продукти взаємодії кислот з основами, то в залежності від їх сили розрізняють чотири типи солей:
1)солі, утворені сильною кислотою і сильною основою;
2) солі, утворені слабкою кислотою і сильною основою;
3) солі, утворені сильною кислотою і слабкою основою;
4) солі, утсорені слабкою кислотою і слабкою основою.
Солі першого типу не підлягають гідролізу, оскільки не утворюють слабких електролітів при взаємодії з водою.
Гідроліз солей, утворених сильною основою і слабкою кислотою розглянемо на прикладі цианіду калію.
KCN  K+ + CN-
K+ + CN-
H2O  H++OH-.
H++OH-.
В розчині поряд з молекулами води присутні іони К+, OH-, H+ i CN-. Вони взаємодіють між собою, утворюючи малодисоційовані молекули HCN. Сіль підлягає гідролізу:
KCN + H2O  KOH + HCN
KOH + HCN
CN- + H2O  OH- + HCN.
OH- + HCN.
В результаті гідролізу збільшується концентрація іонів ОН- і рН розчину зростає: рН >7. Середовище лужне.
При розчиненні в воді солі, утворенної сильною кислотю і слабкою основою, наприклад хлориду амонію:
NH4Cl  NH4+ + Cl-
NH4+ + Cl-
H2O  H+ + OH-.
H+ + OH-.
В розчині з’являються іони NH4+, Cl-, H+, OH-. Іони NH4+ і OH- взаємодіють між собою і утворюють слабкодисоційовані молекули NH4ОН. Це означає, що сіль підлягає гідролізу.
NH4Cl + Н2О  NH4ОН +НCl
NH4ОН +НCl
NH4+ + Н2О  NH4ОН + Н+
NH4ОН + Н+
В результаті гідролізу збільшується концентрація іонів водню Н+ і рН зменшується: рН < 7. Середовище кисле.
Найбільш повному гідролізу підлягають солі, утворені слабкою кислотою і слабкою основою. В результаті розчинення цианіду амонію, наприклад, в розчині з’являються чотири вида іонів:
NH4+, CN-, H+ i OH-, які попарно взаємодіють з утворенням слабкої кислоти: Н+ + СN-  HCN і слабкої основи: NH4+ + ОН-
HCN і слабкої основи: NH4+ + ОН-  NH4ОН. Сумарне рівняння гідролізу виражається рівнянням:
NH4ОН. Сумарне рівняння гідролізу виражається рівнянням:
NH4СN + Н2О  NH4ОН+ HCN.
NH4ОН+ HCN.
В результаті гідролізу солей, подібних до цианіду амонію, в розчині утворюється слабка кислота і слабка основа і рН розчину близько до 7. Середовище нейтральне.
При розчиненні солей багатоосновних кислот або багатокислотних основ, гідроліз протікає ступінчасто:
Na2S + H2O  NaHS + NaOH
NaHS + NaOH
S2- + H2O  HS+ + OH-
HS+ + OH-
NaHS+ + Н2О  H2S + NaOH
H2S + NaOH
HS- +H2O  H2S + ОН-
H2S + ОН-
Ступінь гідролізу залежить від хімічної природи утвореного слабкого електроліту і вона тим вище, чим слабкіше цей електроліт.
Так як гідроліз – процес ендотермічний, то при підвищенні температури повинна збільшуватись його інтенсивність (за принципом Ле Шательє). Розбавлення водою сприяє протіканню процесу, пов’язаного з поглинанням води, тобто посиленню гідролізу.
КОНТРОЛЬНІ ЗАВДАННЯ
Розчини. Електрохімічні процеси.
3.1. Обчисліть молярну концентрацію розчину хлориду кальцію /густина 1,178 г/см3/, якщо масова частина CaCl2 в розчині складає 20%.
3.2. Обчисліть масову частку солі в розчині, який містить 280г води і 40г солі.
3.3. У 200г води розчинили 50г цукру. Визначте масову частку цукру в розчині.
3.4. Визначте масову частку розчиненої речовини, якщо в 200г води знаходиться 20г речовини.
3.5. Визначте масу води і масу хлориду натрію NaCl, які потрібні для приготування: а/ 250г розчину з масовою часткою NaCl 10% /0,1/;
б/ 0,5г розчину з масовою часткою NaCl,15% /0,15/;
в/ 500г розчину з масовою часткою NaCl 20% /0,2/.
3.6. Визначте масу цукру яка містить:
а/ в 1кг розчину з масовою часткою цукру 20%;
б/ в 200г розчину з масовою часткою цукру 5%.
3.7. Визначте масу йоду і масу спирту, які потрібно взяти для приготування 500г розчину з масовою часткою йоду 0,5 /5%/.
3.8. Визначте масу солі, яку потрібно розчинити в 10 кг води, щоб приготувати розчин з масовою часткою солі 10%.
3.9. Обчисліть масу води, яка потрібна для приготування розчину з масовою часткою солі 10% із 10г солі.
3.10. До 120г розчину з масовою часткою речовини 28% додали 216мл води. Знайдіть масову частку розчиненої речовини нового розчину.
3.11. Змішали 20кг розчину з масовою часткою речовини 8% і 10кг розчину з масовою часткою речовини 12%. Визначте масову частку розчиненої речовини нового розчину.
3.12. Визначте масу сульфату натрія, яка необхідна для приготування 5л розчину з масовою часткою речовини 0,08. / 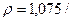 .
.
3.13. До 500мл розчину кислоти з масовою часткою речовини 0,32 / 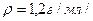 додали 1л води. Знайдіть масову частку розчиненої речовини нового розчину.
додали 1л води. Знайдіть масову частку розчиненої речовини нового розчину.
3.14. Визначте об’єм розчину сірчаної кислоти з масовою часткою речовини 0,08 /8%/ / 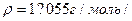 , який потрібний для приготування 500г розчину сірчаної кислоти з масовою часткою 1%.
, який потрібний для приготування 500г розчину сірчаної кислоти з масовою часткою 1%.
3.15. Знайдіть масу сірчаної кислоти H2SO4, яка необхідна для приготування 500мл 2М розчину.
3.16. Знайдіть масу азотної кислоти HNO3, яка містить в 200мл 0,1М розчину.
3.17. В якому об’ємі 1М розчину містить 4,9г сірчаної кислоти H2SO4?
3.18. Визначте молярну концентрацію розчину, якщо в 400мл розчину міститься 10,5г гідроксиду калію KOH.
3.19. У 200мл розчину міститься 5,6г гідроксиду калію KOH. Визначте молярну концентрацію розчину.
3.20. Визначте молярну концентрацію розчину, одержаного при розчинені 42,6г сульфату натрію Na2SO4 в 300г води, якщо густина розчину 1,12г/мл.
3.21. Яка маса хлориду калію KCl потрібна для того, щоб приготувати розчин цієї солі об’ємом 300мл і концентрацію 0,15моль/л.
3.22. Який об’єм 5М розчину гідроксиду калію KOH потрібно взяти, щоб приготувати 0,6М розчин KOH об’ємом 250мл?
3.23. Яка маса хлориду калію KCl містить в його розчині молярної концекнтрації 0,3 моль/л і об’ємом 400мл?
3.24. Яку масу оксиду фосфору P2O5 потрібно взяти для приготування розину фосфатної кислити H3PO4 об’ємом 300 мл і молярної концетрації 0,2 моль/л?
3.25. Обчисліть масу нітрату калію KNO3, необхідно для приготування 500 мл розину, в якому молярна концентрація дорівнює 0,2 моль/л.
3.26. В якому об’ємі 0,1 н розчину міститься 8 г сульфату міді CuSO4 ?
3.27. Яка маса карбонату натрію міститься в розчині об’ємом 250 мл, в якому нормальна концентрація дорівнює 0,2 моль/л?
3.28. В розчині об’ємом 2 л міститься каоьонат натрію Na2CO3 масою 21,2 г. Визначте молярну і нормальну концентрації цього розч4ину.
3.29. Яка маса сірчаної кислоти H2SO4 містить в розчині об’ємом 250 мл, якщо цого нормальна концентрація дорівнює 0,1 моль/л?
3.30. В розчині об’ємом 250 мл міститься сульфат алюмінію Al2(SO4)3 масою 7,5 г. Чому дорівнює нормальна концентрація цьго розчину?
3.31. На пілставі лектронних і електро-іонних рівнянь розставте коефіцієнти в рівняннях реакції:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1036; Нарушение авторских прав?; Мы поможем в написании вашей работы!