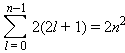КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Білет 1
|
|
|
|
| Білет 1 питання1 Атом -мікрочастинка, яка складається з ядра, що вміщує протони і нейтрони, і електронів, які утворюють зовнішню оболонку |
| Квантові числа - параметри, що визначають електронну структуру і властивості електронів атома n - головне квантове число; визначає енергетичний рівень і енергію електрона n = 1, 2,...[1]... ; l - орбітальне квантове число; визначає енергетичний підрівень, форму орбіталі і енергію електрона l = 0, 1,...[1]... n -1; m l - магнітне квантове число; визначає просторову орієнтацію атомних орбіталей m l= - 1... [1]...+ 1; m s - спінове квантове число; визначає власний механічний і магнітний момент електрона m s= -1/2 або +1/2 Кількість енергетичних підрівнів на енергетичному рівні дорівнює n Кількість орбіталей на енергетичному підрівні дорівнює 2 l + 1 Електронна ємність енергетичного підрівня дорівнює 2·(2 l + 1) |
| Принцип Паулі - в атомі не може бути двох або більше електронів з однаковим набором всіх чотирьох квантових чисел Правило Гунда - сумарне спінове число електронів на даному підрівні повинне бути максимальним Правило Клечковського - енергетичні підрівні заповнюються у порядку зростання величини n + l, а при рівних значеннях - у порядку зростання величини n. |
А́томною орбіта́ллю у хімії називають базисну хвильову функцію електрона в атомі.
Електронні орбіталі класифікують за орбітальними квантовими числами.
l =0. Такі орбіталі називаються s-орбіталями. Вони сферично симетричні.
 ,
,
де Yl , m — відповідні сферичні гармоніки, а f(r) — радіальна хвильова функція, яка залежить від інших квантових чисел і яка розраховується при розв'язанні стаціонарного рівняння Шредінгера.
l = 1. Такі орбіталі називаються p-орбіталями й мають витягнутий гантелеподібний вигляд. Існує три (2l+1) p-орбіталі, направлені вздовж трьох осей координат. Їх позначають 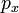 ,
,  ,
,  . Три p-орбіталі відрізняються магнітним квантовим числом m.
. Три p-орбіталі відрізняються магнітним квантовим числом m.
l = 2. Такі орбіталі називаються d-орбіталями. Існує п'ять d-орбіталей, які позначаються 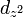 ,
,  ,
, 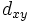 ,
,  ,
, 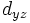 .
.
l = 3 відповідає семи f-орбіталям.
Молекулярна орбіталь — наближена хвильова функція електронів молекули, утворена суперпозицією атомних орбіталей різних атомів.
Електронний стан, який описується молекулярною орбіталлю, делокалізований у межах усієї молекули.Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.
Принцип наименьшей энергии требует, чтобы электроны заселяли в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
ПринципПаули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2 l + 1 орбитали, на которых размещаются не более 2(2 l + 1) электронов. Отсюда следует, что емкость s -орбиталей – 2, p -орбиталей – 6, d -орбиталей – 10 и f -орбиталей – 14 электронов. ФормулА Бора–Бьюри, определяет общее число электронов на уровне с заданным n:
|
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правиломГунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: 

 , и суммарный спин S = 3/2, а не так:
, и суммарный спин S = 3/2, а не так: 
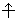
 , S = 1/2.
, S = 1/2.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 445; Нарушение авторских прав?; Мы поможем в написании вашей работы!