
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Білет 1 питання3
|
|
|
|
Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі.
Рудольф Клаузіус визначив зміну ентропії термодинамічної системи при оборотному процесі як відношення загальної кількості теплоти ΔQ, отриманої або втраченої системою, до величини абсолютної температури T: 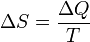 Зв'язок між теплоємністю та ентропією дається формуою
Зв'язок між теплоємністю та ентропією дається формуою 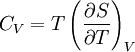 Згідно з визначенням Больцмана, ентропія є функцією стану. Більш того, оскільки (Ω) може бути тільки натуральним числом (1,2,3.), ентропія повинна бути додатньою — виходячи з властивостей логарифма Ентропія є екстенсивною величиною(залежить від маси і об'єму системи), тому сумарна ентропія двох систем S = S 1 + S 2
Згідно з визначенням Больцмана, ентропія є функцією стану. Більш того, оскільки (Ω) може бути тільки натуральним числом (1,2,3.), ентропія повинна бути додатньою — виходячи з властивостей логарифма Ентропія є екстенсивною величиною(залежить від маси і об'єму системи), тому сумарна ентропія двох систем S = S 1 + S 2
Ентальпі́я (або теплова функція, від грец. «нагріваю») — термодинамічний потенціал, що характеризує стан термодинамічної системи при виборі як основних незалежних змінних ентропії (S) і тиску (P). Ентальпія — адитивна функція, тобто ентальпія всієї системи дорівнює сумі ентальпій її складових частин. Із внутрішньою енергією E системи ентальпія зв'язана співвідношенням: 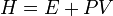 , Ентальпія залежить від тиску й ентропії системи, тобто при незмінних N і xi її повний диференціал дорівнює:
, Ентальпія залежить від тиску й ентропії системи, тобто при незмінних N і xi її повний диференціал дорівнює: 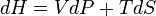 . Ентальпія використовується для опису ізобарних процесів, тобто процесів, які відбуваються при сталому тиску. Якщо процес проходить при сталому тиску, то приріст ентальпії дорівнює переданій тілу теплоті dQ = TdS. Тож,
. Ентальпія використовується для опису ізобарних процесів, тобто процесів, які відбуваються при сталому тиску. Якщо процес проходить при сталому тиску, то приріст ентальпії дорівнює переданій тілу теплоті dQ = TdS. Тож, 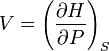 ,
, 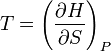 .
.
Вільна енергія Гіббса (або потенціал Гіббса,)- це термодинамічний потенціал такого вигляду: 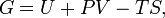 Енергію Гіббса можна розуміти як повну хімічну енергію системи (кристала, рідини і т.п.)
Енергію Гіббса можна розуміти як повну хімічну енергію системи (кристала, рідини і т.п.)
Класичним визначенням енергії Гіббса є вираз 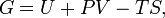
Диференціал енергії Гіббса для системи з постійним числом частинок, виражений у власних змінних - через тиск p і температуру T: 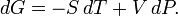
Для системи із змінним числом частинок цей диференціал записується так: 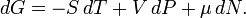
Тут μ - хімічний потенціал, який можна визначити як енергію, яку необхідно затратити, щоб додати в систему ще одну частку.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 450; Нарушение авторских прав?; Мы поможем в написании вашей работы!