
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зв'язок з хімічним потенціалом
|
|
|
|
Використовуючи властивості екстенсивності термодинамічних потенціалів, математичним наслідком яких є співвідношення Гіббса-Дюгема, можна показати, що хімічний потенціал є відношенням енергії Гіббса до числа частинок в системі: 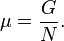
Енергія Гіббса і напрям ходу реакції
У хімічних процесах одночасно діють два протилежні фактори - ентропійний (T Δ S) і ентальпійний (Δ H). Сумарний ефект цих протилежних факторів у процесах, що перебігають при постійному тиску і температурі, визначає зміна енергії Гіббса (G): 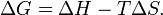
З цього виразу випливає, що 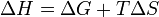 , тобто деяка кількість теплоти витрачається на збільшенні ентропії (T Δ S), ця частина енергії втрачена для здійснення корисної роботи, її часто називають зв'язаною енергією. Інша частина теплоти (Δ G) може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
, тобто деяка кількість теплоти витрачається на збільшенні ентропії (T Δ S), ця частина енергії втрачена для здійснення корисної роботи, її часто називають зв'язаною енергією. Інша частина теплоти (Δ G) може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 374; Нарушение авторских прав?; Мы поможем в написании вашей работы!