
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Білет 1 питання 2
|
|
|
|
Електролітична дисоціація — явище розпаду нейтральних молекул на іони, що відбувається в електролітах. Наприклад, молекула солі NaCl розпадається при розчиненні на іони Na+ та Cl-.
pH, Водневий показник — величина, що показує міру активності іонів водню (Н+) в розчині, тобто ступінь кислотності або лужності цього розчину. Для розведених розчинів можна користуватись терміном «концентрація» замість «активність» у цьому визначенні.
У водних розчинах активність іонів водню визначається константою дисоціації води (Kw=1.011 × 10−14 при 25 °C) та взаємодією з іншими іонами в розчині. Водні розчини із значенням рН, меншим ніж 7, вважаються кислотними, із значенням рН більшим 7 — лужними.
Формула для обчислення величини рН (що не має одиниць розмірності) є наступною: 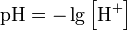
рН абсолютно чистої води мусить мати значення 7. Але в реальності такого майже ніколи не трапляється — наприклад завдяки тому, що, при розчинюванні у воді вуглекислого газу (СО2) з повітря, утворюється вугільна кислота Н2СО3, яка при дисоціації на іони Н+ та СО32- може зменшувати значення рН води до величини 5.7-6.
Розрахунок для розчинів
Значення pH для слабких та сильних кислот можна розрахувати, використовуючи деякі припущення.
Процес розчинення сильної кислоти, наприклад соляної, у воді можна записати, як: HCl(aq) → H+ + Cl−
Тобто приймаєтся, що в 0.01 M розчині HCl концентрація іонів гідроксонію також становить 0.01 M. Отже: pH = −log10 [H+]:
pH = −log (0.01) що дорівнює 2.
Раствори електролитів, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Р-орбитель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Растворы электролитов обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные св-ва бесконечно разбавленных растворов электролитов, существенно отличаются от тех же св-в растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич.давления в сравнении со значением, предсказываемым законом Вант-Гоффа понижение давления пара р-рителя над р-ром в сравнении с предсказываемым Рауля законом и др. Наличием ионов обусловлены также классификация растворов электролитов, особенности теоретич. подходов в сравнении с др. классами р-ров. Неводные растворы электролитов служат средой для проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения в-в и др.).
Неелектроліт - речовина, яка не піддається дисоціації на іони, в силу чого її водний розчин не може проводити електричний струм; прикладом неелектроліту може служити водний розчин цукру. Неелектроліти – речовини з ковалентним неполярним зв'язком.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!