
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію
|
|
|
|
Алюміній — металічний елемент головної підгрупи ІІІ групи 3 періоду періодичної системи хімічних елементів. Електронна конфігурація зовнішнього енергетичного рівня його атома 3 s 23 p 1. При хімічних взаємодіях у збудженому стані він здатен утворювати три ковалентних зв’язки або повністю віддавати свої три електрони, проявляючи у своїх сполуках ступінь окиснення +3. Отже, Алюміній є активним відновником.
Алюміній по поширеності займає третє місце серед інших елементів. Масова частка Алюмінію в земній корі становить 8,5 %. У природі він зустрічається тільки у вигляді сполук. Він входить до складу алюмосилікатів, до яких належать: глини, слюди, польові шпати, зокрема каолін. Промислово важливою алюмінієвою рудою є боксит Al2O3 · n Н2О. Алюміній входить до складу мінералу корунду, який є кристалічним алюміній оксидом Al2O3. Різні домішки здатні надавати корундові різних кольорів. зеленого, жовтого, жовтогарячого, фіолетового та інших кольорів й відтінків. Його синій різновид називають сапфіром, а червоний — рубіном. І рубіни, і сапфіри є коштовними каменями.
Проста речовина алюміній — блискучий сріблясто-білий метал. Він має високу здатність відбивати світлові та теплові промені, а також високі тепло- та електропровідність. Температура плавлення алюмінію 660 °С. Це досить легкий і пластичний метал. З нього можна виробляти тонкий дріт і фольгу.
Хімічно алюміній дуже активний. На повітрі він швидко окиснюється і вкривається тонкою плівкою алюміній оксиду. Оксидна плівка є досить міцною й зумовлює корозійну стійкість алюмінію. При нагріванні на повітрі чи в кисні алюміній згоряє, утворюючи також алюміній оксид:
4Al + 3O2 = 2Al2O3.
Алюміній активно реагує з іншими неметалами. За звичайних умов він взаємодіє з хлором і бромом, утворюючи солі, наприклад, алюміній хлорид:
2Al + 3Сl2 = 2AlСl3.
Реакція алюмінію з йодом відбувається, якщо до суміші алюмінієвого порошку з йодом додати кілька крапель води, яка виконує роль каталізатора:
2Al + 3I2 = 2AlІ3.
При нагріванні алюміній реагує з сіркою, азотом, вуглецем, наприклад:
2Al + 3S = Al2S3.
У звичайному стані алюміній покритий захисною оксидною плівкою і є стійким до дії води навіть при нагріванні. Якщо плівка алюміній оксиду буде зруйнована, то алюміній буде активно реагувати з водою з виділенням газуватого водню:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Алюміній реагує з розчинами кислот з утворенням солей і водню, наприклад:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентровані сульфатна і нітратна кислоти пасивують алюміній, тобто збільшують міцність оксидної плівки. Таким чином, алюміній з ними не реагує.
Оксидна плівка легко розчиняється в лугах і алюміній реагує з розчинами лугів з виділенням водню:
2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
Алюміній відновлює метали з їхніх оксидів при нагріванні (алюмінотермія), наприклад:
Fe2O3 + 2Al = 2Fe + Al2O3.
Алюміній добувають шляхом електролізу глинозему розчиненого в розплавленому кріоліті Na3[AlF6].
Алюміній оксид (глинозем)
Біла тверда речовина, тугоплавка, з дуже високою твердістю. У природі зустрічається у вигляді корунду та його різновидів.
Добування.
— У промисловості з мінералів: бокситів або нефелінів.
— У лабораторії:
1) спалювання алюмінію:

2) прожарювання алюміній гідроксиду:
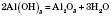
Хімічні властивості.
Алюміній оксид виявляє амфотерні властивості, тобто реагує як з кислотами, так і з основами (див. таблицю).
Хімічні властивості алюміній оксиду
| Реагент | Рівняння реакції | Продукти реакції | Умови перебігу реакції |
| Хлоридна кислота | 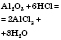
| Алюміній хлорид і вода | Нагрівання |
| Твердий натрій гідроксид | 
| Натрій метаалюмінат і вода | Нагрівання, сплавлення |
| Розчин натрій гідроксиду | 
| Натрій тетрагідроксо-алюмінат | Нагрівання |
Застосування:
— у лазерах;
— як абразивний матеріал;
— ювелірні прикраси, годинники;
— як тугоплавкий матеріал.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 920; Нарушение авторских прав?; Мы поможем в написании вашей работы!