
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порівняльна характеристика спиртів
|
|
|
|
| Одноатомні спирти | Багатоатомні спирти | Феноли | |
| визначення | Спирти, що містять одну гідроксогрупу | Спирти, що містять кілька гідроксогруп | Спирти, що містять гідроксогрупу, що безпосередньо зв’язана з бензольним ядром. |
| Функціональна група | Одна гідроксогрупа - ОН | Кілька гідроксогруп - ОН | Бензольне ядро і гідроксогрупа |
| Загальна формула | СnН2n+1ОН | СnН2n+2-х (ОН)х | СnН2n-7ОН, n≥6 |
| Гомологічний ряд | СН3ОН – метанол,деревний спирт С2Н5ОН –етанол, винний спирт С3Н7ОН – пропанол С4Н9ОН – бутанол С5Н11ОН – пентанол С6Н13ОН – гексанол |  СН2 – ОН етиленгліколь,
СН2 – ОН (етан-1,2-диол) СН2 – ОН етиленгліколь,
СН2 – ОН (етан-1,2-диол)
 СН2 – ОН гліцерин СН2 – ОН гліцерин
 СН – ОН (пропан -1,2,3-триол)
СН2 – ОН СН – ОН (пропан -1,2,3-триол)
СН2 – ОН
|  ОН
С6Н5ОН - фенол ОН
С6Н5ОН - фенол  
|
| Систематична номенклатурна назва | Нумерація починається з того краю, де ближче гідроксогрупа, закінчення – ол, між коренем та закінченням номер карбону біля якого розміщена гідроксогрупа.
  С1Н3 – С2Н – С3Н2 – С4Н – С5Н3
ОН СН3
4-метилпентан-2-ол С1Н3 – С2Н – С3Н2 – С4Н – С5Н3
ОН СН3
4-метилпентан-2-ол
| Нумерація починається з того краю, де ближче гідроксогрупа, суфікс вказує кількість гідроксогруп, закінчення – ол, між коренем та закінченням номера карбону біля яких розміщені гідроксогрупи.
   С1Н3 – С2Н – С3Н2 – С4Н – С5Н3
ОН ОН СН3
4-метилпентан-1,2-диол С1Н3 – С2Н – С3Н2 – С4Н – С5Н3
ОН ОН СН3
4-метилпентан-1,2-диол
|  ОН ОН
    СН3 2,5-диметилфенол
СН3 Нумерація починається від гідроксогрупи, закінчення фенол. СН3 2,5-диметилфенол
СН3 Нумерація починається від гідроксогрупи, закінчення фенол.
|
| Ізомерія | 1. карбонового ланцюга 2. положення гідроксогрупи 3.міжкласова ізомерія з простими ефірами (етерами) | 1. карбонового ланцюга 2. положення гідроксогрупи | 1.Положення замісника 2. між класова з ароматичними спиртами. |
| Будова молекули. |  Оксиген більш електронегативний, тому до нього відбувається перетяг електронної пари від Н. Тому на Оксигені виникає заряд «σ-», а на Гідрогені виникає заряд«σ+»,атом Гідрогену стає більш рухливий, може легше відриватись ніж у вуглеводнів, заміщуючись на атом активного металу, тому спирти у хімічних реакціях проявляють дуже слабкі кислотні властивості.
Оксиген більш електронегативний, тому до нього відбувається перетяг електронної пари від Н. Тому на Оксигені виникає заряд «σ-», а на Гідрогені виникає заряд«σ+»,атом Гідрогену стає більш рухливий, може легше відриватись ніж у вуглеводнів, заміщуючись на атом активного металу, тому спирти у хімічних реакціях проявляють дуже слабкі кислотні властивості.
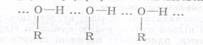 Між двома молекулами спиртів виникає водневий зв'язок, тому спирти рідини та добре розчинні у воді.
Між двома молекулами спиртів виникає водневий зв'язок, тому спирти рідини та добре розчинні у воді.
| Оскільки в молекулах є кілька гідроксогруп, то властивості багатоатомних спиртів схожі на властивості одноатомних спиртів, але перетяг електронної хмари у гідроксогрупах значно сильніший, внаслідок чого збільшуються кислотні властивості цих речовин і вони, на відміну одноатомних спиртів можуть реагувати навіть з нерозчинними основами, та збільшується сила водневих зв’язків, між молекулами, тому збільшується густина сполук. | 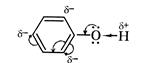 Бензольне ядро більш електронегативне ніж Оксиген, тому електронна густина зміщується до бензольного ядра і розподіляється в положеннях 2,4,6 де виникають часткові негативні заряди σ- внаслідок цього атом Гідрогену стає більш рухливим і може легко відриватись, вступаючи у реакції заміщення.
У гідроксогрупі перетяг електронної густини значно сильніше ніж у звичайних спиртах, тому фенол проявляє сильніші кислотні властивості ніж одно- чи багатоатомні спирти(змінює колір індикаторів). Оскільки ОН група більш полярна і є велике бензольне ядро, то фенол є твердою речовиною частково розчинним у воді.
Бензольне ядро більш електронегативне ніж Оксиген, тому електронна густина зміщується до бензольного ядра і розподіляється в положеннях 2,4,6 де виникають часткові негативні заряди σ- внаслідок цього атом Гідрогену стає більш рухливим і може легко відриватись, вступаючи у реакції заміщення.
У гідроксогрупі перетяг електронної густини значно сильніше ніж у звичайних спиртах, тому фенол проявляє сильніші кислотні властивості ніж одно- чи багатоатомні спирти(змінює колір індикаторів). Оскільки ОН група більш полярна і є велике бензольне ядро, то фенол є твердою речовиною частково розчинним у воді.
|
| Застосування спиртів | Метанол: ЯД!розчинник, для добування формальдегіду, барвників, фотореагентів, ліків. Етанол: добувають синтетичний каучук, діетиловий ефір, барвників, оцтової кислоти, бездимного пороху, пластмас; використовують як паливо, як розчинник для одеколонів, лаків, ліків. | Етиленгліколь: ЯД! Виготовлення антифризу та синтетичного волокна лавсану Гліцерин: Виготовлення синтетичних смол, вибухових речовин, ліків, косметики, мазей, кремів; у шкіряному та текстильному виробництві для пом’якшення шкіри та тканин | Фенол: ЯД!Виробництво лікарських речовин, фенолформальдегідних смол, фотографічних проявників,барвників; сильний антисептик і антиоксидант. Вплив на навколишне середовище: води коксохімічних підприємств не достатньо сильно очищуються, тому фенол потрапляє в навколишне середовище, що зумовлює загибель флори і фауни. |
| Добування | Метанол: 1.із синтез газу СО+2Н2→СН3ОН 2. суха перегонка деревини Етанол: 1.бродіння глюкози С6Н12О6→2С2Н5ОН +2СО2 2.гідратація етилену(промисловий спосіб) С2Н4 +Н2О→С2Н5ОН 3.із галогенопохідних алканів СН3СІ +NaOH водний розчин→CH3OH +NaCl 4.Відновлення альдегідів. CH3CHO +H2 →CH3CH2OH | 1.із хлоропохідних алканів
   СН2-СІ + 2NaOH→CH2OH
СН2-СІ CH2OH + 2NaCl
2.гідроліз жирів
3.із продуктів крекінгу нафти
1)CH2=CH-CH3+ O2→CH2CHO+ H2O СН2-СІ + 2NaOH→CH2OH
СН2-СІ CH2OH + 2NaCl
2.гідроліз жирів
3.із продуктів крекінгу нафти
1)CH2=CH-CH3+ O2→CH2CHO+ H2O
   2)CH2=CH-CH2OH+H2O→CH2-CH-CH2
OH OH OH 2)CH2=CH-CH2OH+H2O→CH2-CH-CH2
OH OH OH
| 1.із камяновугільної смоли 2.із бензену 1)С6Н6 + СІ2→ С6Н5СІ +НСІ 2) С6Н5СІ +Н2О→ С6Н5ОН +НСІ |
| Хімічні властивості | 1.окислення А)горіння С2Н5ОН +3О2→2СО2+3Н2О Б) часткове окиснення С2Н5ОН +[ О]→СН3СНО СН3СНО +[ О]→СН3СООН Де [ О]- це KMnO4, H2O2, K2Cr2O7, O2 2.кислотні властивості спиртів: А) взаємодія з активними металами C2H5OH+2Na→C2H5ONa + H2O Б) взаємодія з лугами при нагрівання і в присутності C2H5OH + NaOH →C2H5ONa + H2O В) взаємодія з кислотами (естерифікація) утворюються естери C2H5OH +HOSO2OH →C2H5OSO3H +H2O C2H5OH +HOOCCH3 →C2H5OOCCH3 +H2O Г) взаємодія з спиртами ( мІжмолекулярна дегідратація)утворюються етери C2H5OH + HOC2H5→C2H5OC2H5 +H2O 4.Реакції з розривом С – О звязку: А)взаємодія з галогеноводнями C2H5OH +HBr→C2H5Br + H2O Б) внутрішньомолекулярна дегідратація CH3 – CH – CH – CH3 →CH3 – CH=CH – CH3 +H2O 5.дегідрування(каталізатор мідь 200 0С) C2H5OH →CH3CHO +H2 | Взаємодія з активними металами
  СН2 – ОН +2Na→ СН2 – ОNa
СН2 – ОН СН2 – ОNa +H2
Взаємодія з основами СН2 – ОН +2Na→ СН2 – ОNa
СН2 – ОН СН2 – ОNa +H2
Взаємодія з основами
  СН2 – ОН СН2 – ОNa
СН2 – ОН+NaOH → СН2 – ОNa +H2O
Якісна реакція на багатоатомні спирти – взаємодія з купрум(ІІ) гідроксидом
CuSO4+2NaOH→Cu(OH)2 +Na2SO4 СН2 – ОН СН2 – ОNa
СН2 – ОН+NaOH → СН2 – ОNa +H2O
Якісна реакція на багатоатомні спирти – взаємодія з купрум(ІІ) гідроксидом
CuSO4+2NaOH→Cu(OH)2 +Na2SO4
 СН2–ОН +Сu(OH)2 → H2O +
СН2–ОН СН2–ОН +Сu(OH)2 → H2O +
СН2–ОН
   СН2–О HO-CH2 СН2–О HO-CH2
 СН2–ОН Cu O- CH2
Етилгліконат міді
Взаємодія з кислотами СН2–ОН Cu O- CH2
Етилгліконат міді
Взаємодія з кислотами
  СН2–ОН + 2НNO3→ СН2–ОNO2 +2H2O
СН2–ОН СН2–ОNO2 СН2–ОН + 2НNO3→ СН2–ОNO2 +2H2O
СН2–ОН СН2–ОNO2
| 1.Впливає на індикатори
С6Н5ОН↔ С6Н5О-+Н+
2.взаємодіє з натрієм
2С6Н5OH +2Na→ 2С6Н5ONa +H2
3.взаємодіє з основами
С6Н5OH +NaOH→ С6Н5ONa+H2O
4.Взаємодіє з бромною водою(знебарвлює бромну воду) – якісна реакція на феноли.
С6Н5OH +3Br2→ С6Н2Br3OH +3HBr
  5.взаємодіє з формальдегідом(поліконденсація) 5.взаємодіє з формальдегідом(поліконденсація)
 С6Н5OH +CH2O→ OH С6Н5OH +CH2O→ OH
  -- --CH2- +H2O
6.горять
2C6H5OH +9O2→12CO2+6H2O -- --CH2- +H2O
6.горять
2C6H5OH +9O2→12CO2+6H2O
|
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 391; Нарушение авторских прав?; Мы поможем в написании вашей работы!