
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні поняття хімії
|
|
|
|
Загальні вказівки
ІІ. КОНТРОЛЬНІ ЗАДАЧІ
Навчально-методичний посібник призначено для студентів заочної форми Міжрегіонального Інституту Підвищення Освіти (МІПО) НТУУ “КПІ”. Їх метою є надання допомоги студентам при самостійній роботі над курсом хімії.
Для засвоєння курсу хімії студент повинен використовувати навчальну літературу та керуватися програмою, наведеною у навчально-методичному посібнику. Вивченню навчального матеріалу допоможе стисле викладення окремих розділів курсу та приклади розв’язання типових задач.
За матеріалом програми курсу студенти складають іспит. До іспиту допускаються студенти, які виконаливсі лабораторні роботи, своєчасно підготували контрольне завдання та захистили його під час співбесіди з викладачем. Розв’язання задач контрольних завдань слід оформити в окремому зошиті. Для зауважень рецензента потрібно залишити поля.
При надісланні контрольного завдання студент має вказати прізвище, ім’я, по батькові, адресу, номер варіанта, дату виконання, а також підписати завдання.
Варіант контрольного завдання вказує викладач. Контрольне завдання, що виконане не за своїм варіантом, викладач не рецензує.
Номери та умови задач слід розташовувати у послідовності, що відповідає їх переліку в завданні.
Завдання складається з 12 задач і запитань. Умови задач необхідно переписувати. Для розв’язання задач слід використовувати дані з таблиць, які наведені у додатку. Розв’язки та відповіді на запитання мають бути стислими, але обґрунтованими. Необхідно наводити всі математичні розрахунки. Запис формул і рівнянь реакцій обов’язковий. Для перших 25-ти варіантів номер задач за кожним розділом співпадає з номером варіанту. Наприклад: якщо варіант 1, то потрібно розв’язувати задачі за номером 1 у кожному розділі; якщо варіант 7, всі задачі за номером 7 тощо. Розподіл задач для варіантів 26 – 75 наведено у таблиці на стор. 9.
| НОМЕРИ ЗАДАЧ ЗА ВАРІАНТАМИ ТА РОЗДІЛАМИ | |||||||||||
| № вар. | Номери розділів | ||||||||||
| 1 | 2 | 3 | 4 | 5 | |||||||
| 1 1 2 3 4 5 6 7 8 9 10 11 12 2 2 3 4 5 6 7 8 9 10 11 12 13 3 3 4 5 6 7 8 9 10 11 12 13 14 4 4 5 6 7 8 9 10 11 12 13 14 15 5 5 6 7 8 9 10 11 12 13 14 15 16 6 6 7 8 9 10 11 12 13 14 15 16 17 7 7 8 9 10 11 12 13 14 15 16 17 18 8 8 9 10 11 12 13 14 15 16 17 18 19 9 9 10 11 12 13 14 15 16 17 18 19 20 10 10 11 12 13 14 15 16 17 18 19 20 21 11 11 12 13 14 15 16 17 18 19 20 21 22 12 12 13 14 15 16 17 18 19 20 21 22 23 13 13 14 15 16 17 18 19 20 21 22 23 24 14 14 15 16 17 18 19 20 21 22 23 24 25 15 15 16 17 18 19 20 21 22 23 24 25 1 16 16 17 18 19 20 21 22 23 24 25 1 2 17 17 18 19 20 21 22 23 24 25 1 2 3 18 18 19 20 21 22 23 24 25 1 2 3 4 19 19 20 21 22 23 24 25 1 2 3 4 5 20 20 21 22 23 24 25 1 2 3 4 5 6 21 21 22 23 24 25 1 2 3 4 5 6 7 22 22 23 24 25 1 2 3 4 5 6 7 8 23 23 24 25 1 2 3 4 5 6 7 8 9 24 24 25 1 2 3 4 5 6 7 8 9 10 25 25 1 2 3 4 5 6 7 8 9 10 11 26 24 23 22 21 20 19 18 17 16 15 14 13 27 23 22 21 20 19 18 17 16 15 14 13 12 28 22 21 20 19 18 17 16 15 14 13 12 11 29 21 20 19 18 17 16 15 14 13 12 11 10 30 20 19 18 17 16 15 14 13 12 11 10 9 31 19 18 17 16 15 14 13 12 11 10 9 8 32 18 17 16 15 14 13 12 11 10 9 8 7 33 17 16 15 14 13 12 11 10 9 8 7 6 34 16 15 14 13 12 11 10 9 8 7 6 5 35 15 14 13 12 11 10 9 8 7 6 5 4 36 14 13 12 11 10 9 8 7 6 5 4 3 37 13 12 11 10 9 8 7 6 5 4 3 2 38 12 11 10 9 8 7 6 5 4 3 2 1 39 11 10 9 8 7 6 5 4 3 2 1 25 40 10 9 8 7 6 5 4 3 2 1 25 24 66 9 8 7 6 5 4 3 2 1 25 24 23 67 8 7 6 5 4 3 2 1 25 24 23 22 68 7 6 5 4 3 2 1 25 24 23 22 21 69 6 5 4 3 2 1 25 24 23 22 21 20 70 5 4 3 2 1 25 24 23 22 21 20 19 71 4 3 2 1 25 24 23 22 21 20 19 18 72 3 2 1 25 24 23 22 21 20 19 18 17 73 2 1 25 24 23 22 21 20 19 18 17 16 74 1 25 24 23 22 21 20 19 18 17 16 15 75 25 24 23 22 21 20 19 18 17 16 15 14 |
Короткі теоретичні відомості
Атоми та молекули мають дуже малі абсолютні маси, які неможливо вимірити ніякими технічними пристроями. Тому в хімії та фізиці використовують так звані відносні атомні та молекулярні маси - Аr (Х) і Мr (Х) відповідно (Х – хімічна формула речовини). За одиницю вимірювання при цьому береться маса 1/12 атома Карбону (ізотопу С12). Отже, відносна атомна або молекулярна маса показує, у скільки разів абсолютна маса даної частинки m 0 більша за масу 1/12 атома Карбону:
Ar (X) або Mr (X) = 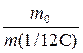 .
.
Наприклад, Ar (С) = 12, Ar (О) = 16, Ar (Н) = 1 тощо.
Відносні атомні та молекулярні маси розмірності не мають. Відносна молекулярна маса дорівнює сумі відносних атомних мас елементів з урахуванням кількості атомів цих елементів у молекулі, наприклад:
Mr (О2) = 2 × 16 = 32;
Mr (СО) = 12 + 16 = 28;
Mr (СО2) = 12 + 2 × 16 = 44;
Mr (CH4) = 12 + 4 × 1 = 16.
Речовина вимірюється її кількістю. Під кількістю речовинирозуміють певне число окремих частинок цієї речовини (атомів, молекул, іонів тощо) - N, або N (X). Але так робити кількісні розрахунки незручно, тому введено спеціальну одиницю кількості - 1 моль, який містить так зване число Авогадро частинок - NА» 6,02 × 1023 моль-1. Абсолютна маса числа Авогадро (тобто одного моля) атомів Карбону дорівнює 12 грамам. Тоді маси одного моля атомів Оксигену, молекул O2, СО, СО2 і CH4 дорівнюють 16, 32, 28, 44 і 16 грамам відповідно.
Маса одного моля речовини називається молярною масою. Вона позначається літерою М, або М (Х), і має розмірність г /моль. Чисельно молярна маса дорівнює відносній молекулярній масі. Кількість молів (або просто кількість) речовини позначають n, або n (X). Для певної маси будь-якої речовини m (X) кількість речовини дорівнює:
n (x) = 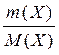 =
= 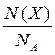 ,
,
а абсолютна маса однієї молекули цієї речовини
m 0(Х) = 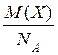 .
.
Наприклад, для Карбону m 0(С) = 12/(6,02 × 1023)» 1,99 × 10-23 г.
При розв’язанні типових задач за цією темою потрібно знати універсальний закон, що діє для газів – закон Авогадро: у рівних об’ємах різних газів, взятих за однакових умов (тиск р і температура Т), міститься однакова кількість молекул.
Наслідки з цього закону:
1. 1 моль будь-якого газу за нормальних умов (р = 1,013 × 105 Па; Т = 273 К) займає об’єм 22,4 літри. Цей об’єм називають молярним об’ємом газу. Він позначається VМ, або VМ (Х), і має розмірність л/моль. Кількість газоподібної речовини через молярний об’єм дорівнює:
n (x) = 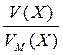 .
.
2. Відносна густина одного газу (Х) за іншим (Y), DY (X), - це відношення мас рівних об’ємів цих газів, взятих за однакових умов, або відношення їх молярних мас:
DY (X) = 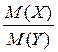 .
.
Приклад 1. Маса 5,6 л (н. у.) деякого газу дорівнює 10 г. Обчисліть для цього газу молярну та відносну молекулярну маси, масу однієї молекули у грамах, кількість речовини та кількість молекул у цьому об’ємі.
Розв’язання. Складаємо пропорцію та знаходимо кількість молів газу:
VМ - 1 моль
V - х,
звідки х = n = 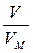 =
= 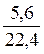 = 0,25 (моль).
= 0,25 (моль).
Знаючи кількість речовини, розраховуємо молярну масу:
М = 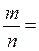
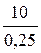 = 40 (г /моль).
= 40 (г /моль).
Відносна молекулярна маса газу чисельно дорівнює молярній масі:
Мr = 40.
Абсолютна маса однієї молекули:
m 0 = 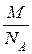 =
= 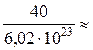 6,66 × 10-23 (г).
6,66 × 10-23 (г).
Кількість молекул:
N = nNA = 0,25 × 6,02 × 1023 = 1,505 × 1023.
При розв’язанні багатьох задач треба вміти робити розрахунки згідно з рівняннями хімічних реакцій. При цьому необхідно знати, що коефіцієнти перед формулами речовин у рівнянні (т. з. стехіометричні коефіцієнти) дають кількісні (мольні) співвідношення реагентів і продуктів реакції. Наприклад, у реакції 2Al + 6HCl = 2AlCl3 + 3H2 на кожні 2 моль Al витрачається 6 моль HCl. При цьому утворюється 2 моль AlCl3 і 3 моль H2.
Приклад 2. Для наведеної вище реакції розрахувати масу хлориду алюмінію AlCl3 і об’єм водню Н2 (н. у.), якщо у реакції беруть участь 5,4 г алюмінію.
Розв’язання. Ar (Al) = 27, Mr (AlCl3) = 106,5. Згідно з рівнянням реакції 1 моль (тобто 27 г) Al відповідає 1 моль (або 133,5 г) AlCl3. Тому складаємо пропорцію:
27 г Al - 133,5 г AlCl3
5,4 г - х,
звідки х = m (AlCl3) = 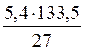 = 26,7 (г).
= 26,7 (г).
Також діємо при розрахунку об’єму водню:
2 × 27 г Al - 3 × 22,4 л H2
5,4 г - у,
звідки у = V (H2) = 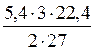 = 6,72 (л).
= 6,72 (л).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!