
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні рекомендації. щодо організації практичних та лабораторних робіт
щодо організації практичних та лабораторних робіт
з дисципліни «Біологія»
| Розробив викладач |
| _____В.Ю. Ковальчук |
П Е Р Е Л І К
лабораторних та практичних робіт з біології
1. Лабораторні роботи
1. Лабораторна робота № 1. Тема: “Вивчення властивостей ферментів”
2. Лабораторна робота № 2. Тема: “Вивчення органічних речовин: вуглеводів та жирів”
3. Лабораторна робота № 3 “Будова клітин прокаріотів і еукаріотів (порівняльний аналіз)”
4. Лабораторна робота № 4 “Будова клітин прокаріотів і еукаріотів (графічне відображення будови)”
5. Лабораторна робота № 5 “Будова хромосом. Мітотичний поділ клітин”
6. Лабораторна робота № 6 “Будова тканин”
7. Лабораторна робота № 7 “Будова статевих клітин. Форми розмноження організмів”
8. Лабораторна робота №8. “Спостереження нормальних та мутантних форм дрозофіл, їх порівняння”
9. Лабораторна робота №9. “Вивчення мінливості у рослин. Побудова варіаційного ряду і варіаційної кривої”
2. Практичні роботи.
1. Практична робота №1. Тема: “Розв’язування елементарних вправ з молекулярної біології”
2. Практична робота №2 “Розв’язування типових вправ з молекулярної біології”
3. Практична робота № 3 “Порівняння мітозу і мейозу”
4. Практична робота №4. “Розв’язування типових задач з генетики. Моногібридне схрещування”
5. Практична робота №5. “Розв’язання типових задач з генетики Дигібридне схрещування”
6. Практична робота №6. “Розв’язування типових задач з генетики. Хромосомна теорія спадковості”
7. Практична робота №7. “Складання родоводів. Розв’язування типових задач на визначення типу мутацій”
8. Практична робота №8. “Розв’язування задач з екології”
9. Практична робота №9. “Складання схем колообігу речовин у екосистемах”
10. Практична робота №10. “Порівняння поновлюваних та не поновлюваних ресурсів біосфери”
11. Практична робота №11. “Порівняння природного і штучного добору”
12. Практична робота №12. “Аналіз пристосувань організмів до умов середовища”
Лабораторна робота №1
1. Тема роботи: “Вивчення властивостей ферментів”
2. Мета роботи: 2.1 На прикладі ферменту каталази вивчити властивості й умови активності ферментів, як біологічних каталізаторів.
2.2 На прикладі розчину білка курячого яйця вивчити здатність білків змінювати свою структуру та властивості під дією різних факторів.
3. Обладнання: 3.1 Розчин білка курячого яйця.
3.2 Свіжа терта картопля.
3.3 3 %-й розчин перекису водню, пробірки, пінцети, градуйовані піпетки, спиртівка, сірники, дистильована вода
4. Завдання: 4.1. Вивчити дію високої температури на структуру і властивості білка курячого яйця.
4.2 Вивчити прискорення ферментом каталазою процесу розщеплення Н2О2 до води і кисню.
4.3 Скласти звіт про проведену роботу.
5. Короткі теоретичні відомості:
5.1 Білки
Білки (протеїни, від грец. protos – перший, головний) – це високомолекулярні біополімери мономерами яких є залишки амінокислот.
Біополімери (від грец. біос та поліс – численний) – високомолекулярні органічні сполуки – білки, нуклеїнові кислоти, складні вуглеводи (полісахариди), молекули яких складаються з великої кількості однакових чи різних за хімічною будовою ланок, що повторюються.
Мономери (від грец. монос – один, поодинокий) – прості молекули із залишків яких складаються біополімери.
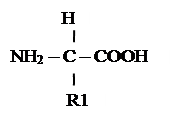
Амінокислоти – це органічні сполуки, до складу яких входять аміногрупа і карбоксильна група.
Аміногрупа (– NH2) має лужні властивості, карбоксильна група (– COOH) має кислотні властивості.
Радикали амінокислот (R) – групи атомів, за якими амінокислоти розрізняють між собою.
Загальна формула амінокислот:
|

|
|
|
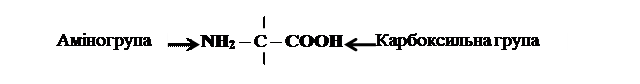

Основні амінокислоти – двадцять амінокислот, залишки яких входять до складу білків.
Амінокислоти можуть сполучатись одна з одною за допомогою спеціального зв’язку – пептидного.
Пептидний зв'язок (від грец. пептос – зварений) – це міцний ковалентний зв'язок між аміногрупою однієї амінокислоти і карбоксильною групою іншої амінокислоти.
Загальна формула пептидного зв’язку:
 |  | ||||||
|
| ||||||

|
|
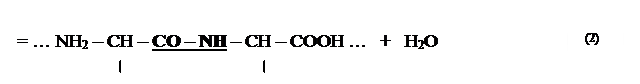
Пептидний зв’язок
Поліпептиди – структури, які складаються з великої кількості амінокислотних залишків. Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Білки складаються з одного або кількох поліпептидних ланцюгів, які можуть містити до кількох тисяч амінокислотних залишків.
Структурна організація білків – це упорядкований стан білків при якому вони спеціальним чином згорнуті, тобто впорядковані у просторі.
Відомо чотири рівні структурної організації білків: первинний, вторинний, третинний, четвертинний.
Первинна структура білків – це число і послідовність амінокислотних залишків у поліпептидному ланцюгу.
Рисунок 1: Схема первинної структури білку
Вторинна структура білків – це спосіб упаковки поліпептидного ланцюга в альфа-спіраль або бетта-шар.
α-спіраль має вигляд правильної спіралі, яка стабілізується водневими зв’язками, що утворюються між атомом Гідрогену NH2-групи однієї амінокислоти (розташованої на одному витку спіралі) й атомом Оксисену СО-групи іншої амінокислоти (розташованої на іншому витку спіралі) Радикали амінокислот не беруть участі у формуванні водневих зв’язків і обернені назовні від спіралі.
У β-шару поліпептидний ланцюг (ланцюги) не скручений у спіраль, а має зигзагоподібну конфігурацію (структуру складчастого листка). Β-шар також стабілізується водневими зв’язками, у формуванні яких беруть участь атом Гідрогену NH2-групи однієї амінокислоти і Оксиген СО-групи іншої амінокислоти.
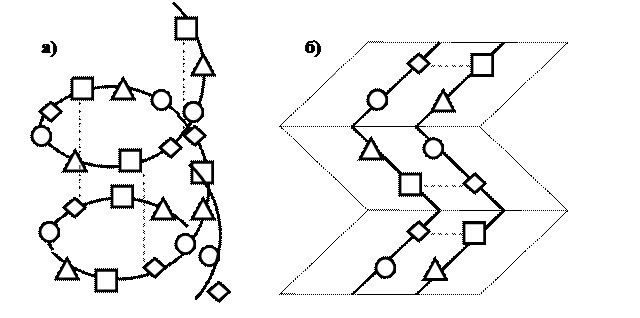
Рисунок 2: Схема вторинної структури білку (а – α-спіраль; б – β-шар)
Третинна структура білку – це спосіб упаковки альфа-спіралі в просторову глобулу (від лат. глобулюс – кулька).

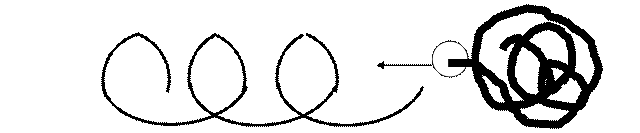
Рисунок 3: Схема третинної структури білку
Четвертинна структура білку – це спосіб упаковки декількох окремих глобул, які разом утворюють функціональну одиницю.
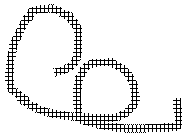

Функції білків:
1) ферментативна (каталітична) – ферменти прискорюють хімічні реакції, що відбуваються в організмі (наприклад, амілаза);
2) захисна – білки утворюють антитіла і антигени, які захищають організм від чужорідних білків бактерій та вірусів (наприклад, імуноглобуліни);
3) рухова – скоротливі білки входять до складу м’язових волокон,
мікротрубочок, війок, джгутиків (наприклад, білки актин і міозин);
4) структурна (будівельна) – білки входять до мембранних структур клітин (наприклад, білки кератин і колаген);
5) запаслива – деякі білки можуть відкладатися про запас (наприклад яєчний альбумін, казеїн молока);
6) транспортна – зв’язують і переносять речовини (наприклад, гемоглобін);
7) рецепторна (сигнальна) – окремі складні білки клітинних мембран здатні реагувати на специфічні хімічні сполуки та передавати сигнали про ці речовини в клітину (наприклад родопсин);
8) гормональна (регуляторна) – білки-гормони впливають на обмін речовин в організмі (інсулін, гормон росту);
9) енергетична – при повному розщепленні 1г білка вивільняється 17,6 кДж.
Одна із основних властивостей білків – це їхня здатність під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості.
Денатурація (від лат. де – втрата, і натура – природні властивості) – процес порушення природної структури, функцій, властивостей білків, який супроводжується розгортанням поліпептидного ланцюга без зміни його первинної структури.
Під час денатурації порушується четвертинна, третинна, вторинна але не первинна структура білків, цілісність поліпептидного ланцюга зберігається.
Ренатурація (від лат. ре – поновлення) – відновлення початкового стану білку на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють процес денатурації.
Деструкція (від лат. деструкціо – руйнування) – процес порушення первинної структури білків.
5.2 Ферменти
Ферменти (від лат. ферментум – закваска) – це специфічні білки, які виконують функцію біологічних каталізаторів, здатні прискорювати хімічні реакції в клітині. Являють собою прості (однокомпонентні) або складні (двокомпонентні) білки.
Складні білки, на відміну від простих, містять ще й небілкову частину у вигляді певних органічних сполук, катіонів або аніонів.
Активний центр – невелика ділянка молекули ферменту, яка зумовлює каталітичну активність цього ферменту. Його структура відповідає хімічній будові речовин, які вступають у реакцію.
Ферменти (зокрема їхні активні центри) утворюють нестійкий комплекс з речовинами, які вступають в реакцію. Цей комплекс швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому свою структуру, а відповідно і активність, не втрачає і здатний каталізувати наступну подібну реакцію.
Основні властивості ферментів:
1) усі ферменти – глобулярні білки;
2) ферменти збільшують швидкість реакції, але самі в цій реакції не витрачаються;
3) ферменти високо специфічні: один фермент може каталізувати тільки одну реакцію;
4) їх присутність не впливає ні на властивості, ні на природу кінцевого продукту (або продуктів) реакції;
5) фермент завжди більший за субстрат (або субстрати), з якими він взаємодіє;
6) фермент взаємодіє з субстратом за допомогою активного центру – спеціальної ділянки, яка за формою відповідає субстратові;
7) дуже мала кількість ферменту викликає перетворення великих кількостей субстрату;
8) активність ферментів залежить від рН середовища, температури, тиску і від концентрацій, як субстрату, так і самого ферменту;
9) фермент-субстратний комплекс здатний знижувати енергію активації реакції (тобто робити меншою енергію початку реакції), саме це і дозволяє ферменту прискорити перебіг реакції.
 | |||
 | |||
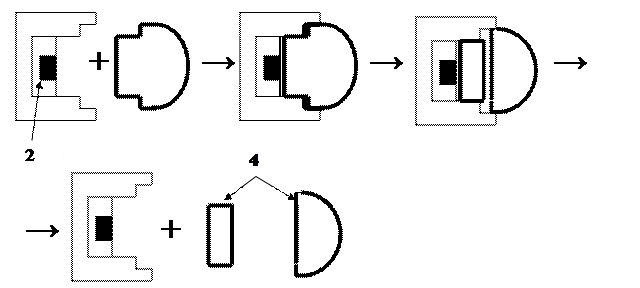
Рисунок 5: Схема дії ферменту
1 – фермент; 2 – активний центр ферменту; 3 – речовина-субстрат;
4 – кінцеві продукти реакції.
6. Порядок проведення роботи:
6.1 Завдання №2: Вивчити дію високої температури на білок курячого яйця
6.1.1 В чисту пробірку додати 3-5 мл. розчину білка курячого яйця.
6.1.2 Прокип’ятити вміст пробірки в полум’ї пальника в продовж 2-3 хвилин. Які зміни ви побачили в пробірці? Про що це говорить?
6.1.3 Результати спостережень запишіть в таблицю № 1 (таблицю розташуйте поперек сторінки).
6.1.4 Зробіть висновок, дайте відповіді на такі запитання:
а) яке явище спостерігається при кип’ятінні білка курячого яйця?
б) Розрив яких зв’язків призвів до денатурації білка?
Таблиця №1: Результати дії високої температури на білок курячого яйця.
| Вміст пробірки | Діючий фактор | Спостереження | Висновки |
| Розчин курячого яйця | Висока температура tº С |
6.2 Завдання №1: Вивчити дію ферменту каталази на перекис водню
Пероксид водню Н2О2 утворюється в живих організмах в результаті природніх окислювально-відновлювальних процесів. Він токсичний, тому в клітинах постійно відбувається процес розщеплення Н2О2 до води і кисню.
В звичайних умовах цей процес протікає доволі повільно, але в живих клітинах реакція прискорюється ферментом каталазою. Активність каталази різна у різних видів рослин і тварин, вона залежить від зовнішніх умов, стану організму та його віку.
Про активність каталази можна судити по такій зовнішній ознаці, як інтенсивність виділення з тканин пухирців кисню. Цей процес можна описати наступною реакцією:
 2Н2О2 КАТАЛАЗА 2Н2О + О2
2Н2О2 КАТАЛАЗА 2Н2О + О2
6.2.1 Візьміть 2 сухі, чисті пробірки, в кожну з них покладіть по 2-3г сирої тертої картоплі.
6.2.2 В пробірку №1 додайте 2-3 мл. дистильованої води, в пробірку № 2 додайте перекису водню.
6.2.3 Збовтайте пробірки №1, №2 і слідкуйте за змінами.
6.2.4 Результати спостережень запишіть в таблицю № 2 (таблицю розташуйте поперек сторінки).
6.2.5 Зробіть висновок.
Таблиця №2: Результати дії каталази в різних умовах
| № | Вміст пробірки | Спостереження | Висновок |
| Сира картопля + Н2О2 | |||
| Сира картопля + дистильована вода |
Зміст звіту.
1 Тема, мета роботи.
2 Опис дій, які здійснювались при виконанні завдання № 1.
3 Таблиця
4 Опис дій, які здійснювались при виконанні завдання № 2.
6 Висновок про проведену роботу.
Контрольні запитання.
1 Що таке білки?
2 Що таке денатурація та ренатурація білка?
3 Які структурні рівні організації білків вам відомі?
4 Що таке фермент?
5 Які функції виконують ферменти?
Використані літературні джерела
| 1. | Батуєв О.С., Гуленкова М.А., Єленевський А.Г. та ін. Біологія: Великий довідник для школярів та абітурієнтів. – Тернопіль: Навчальна книга – Богдан, - 2001. – 576с.: іл. – (Шкільна бібліотека “Богдан”. Великі довідники для школярів та абітурієнтів). |
| 2. | Дмитрієв Ю.В., Тагліна О.В.: Біологія. 10 клас: Розробки уроків. – Х.: Веста: Видавництво «Ранок», 2007. – 176 с. – (Майстер-клас) |
| 3. | Кучеренко М.Є., Вервес Ю.Г., Балан П.Г., Войціцький. Загальна біологія: Підруч. для 10 кл. загальноосвіт. навч. закладів. 2-ге вид. доопр. – К.: Ґенеза, 2005. – 160 с.: іл.. |
| 4. | Полянский Ю.И., Браун А.Д., Верзилин Н.М. и др.; Общая биология: Учеб. для 10-11 кл. сред. шк. – 19-е изд., перераб. – М.: Просвещение, 1989г. – 287 с.: ил. |
| 5. | Ростовцева Л.П., Запорожець Н.В. Зошит для лабораторних, практичних і самостійних робіт з біології. 10 клас (російською мовою). – Х.: Веста: Видавництво «Ранок», 2003. – 88 с. |
Лабораторна робота №2
1. Тема роботи: “ Вивчення органічних речовин: вуглеводів та жирів ”
2. Мета роботи: 2.1 Навчитися визначати жири і полісахариди, які входять до складу організмів.
2.2 Дослідити властивості жирів і полісахаридів які входять до складу організмів.
3. Обладнання: 3.1 Штатив з пробірками, шпатель або ложечка, піпетка.
3.2 Водяна баня або посудина з гарячою водою, лист паперу.
3.3 Кусочок сирої картоплі, насіння соняшника, крохмаль, вода, розчин Люголя або спиртовий 3%-й розчин йоду, розбавлений водою, розчин спирту, ефір або бензин.
4. Завдання: 4.1. Виявити полісахариди (крохмаль) та вивчити їх властивості.
4.2 Виявити жири та вивчити їх властивості.
5. Короткі теоретичні відомості:
5.1 Полісахариди
Вуглеводами називаються органічні сполуки із загальною формулою Cn(H2O)n, де n- дорівнює трьом і більше. У клітинах тварин і людині вміст вуглеводів незначний натомість у клітинах рослин їх значно більше(наприклад у листках,насінні,плодах майже 70%, у бульбах картоплі – до 90%).
Гідроген(H) і Оксиген (O) присутні в цих сполуках у тому ж співвідношенні,що і в молекулі води, тому ці сполуки отримали назву «вуглеводи».
Біологічні властивості вуглеводів залежать від функціональних груп, що входять до їх складу: Карбонільної (яка може біти представлена у вигляді альдегідної або кетонної групи) і гідроксильних груп. У молекулах моносахаридів до всіх атомів Карбону, за винятком одного приєднані гідроксильні групи. Цей один атом карбону входить до складу або альдегідної групи,або кетогрупи. Відповідно всі вуглеводи поділяють на альдози і кетози.
|
|
Дата добавления: 2015-05-24; Просмотров: 2000; Нарушение авторских прав?; Мы поможем в написании вашей работы!