
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Результати титрування 3 страница
|
|
|
|
Реакція на йон Sr2+ з сірчаною кислотою H2SO4
До 1 мл розчину солі стронцію прилити 0,5 мл розчину сірчаної кис-
лоти, якщо осад відразу не випадає, то дати постояти.
SrCl2 + H2SO4 = SrSO4 + 2HCl
Sr2+ +  = SrSO4
= SrSO4
Аналітична реакція на йон Cr2+
У пробірку налити 1–2 мл розчину солі Cr2(SO4)3, долити 3–5 мл розчину NaOH та добавити 3–4 краплі розчину H2O2. Нагріти до появи жовтого забарвлення  . Написати рівняння відповідних реакцій.
. Написати рівняння відповідних реакцій.
Аналітична реакція на йон Mn2+
У пробірку налити 1–2 краплі дуже розведеного розчину MnSO4, 1–2 краплі AgNO3 (каталізатор), 1 мл розчину NaOH з с(NaOH) = 2 моль/л та
1 мл розчину Na2S2O8. Підігріти. Розчин забарвлюється у характерний червоно-фіолетовий колір  . Написати рівняння реакцій. Чи мож-
. Написати рівняння реакцій. Чи мож-
ливе використання цієї реакції для визначення йонів Ag+?
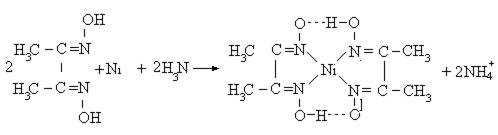
Аналітичні реакції на йон Ni2+ з диметилгліоксимом
(реакція Л.А. Чугаєва)
У пробірку налити краплю розчину солі нітрату нікелю (ІІ), додати
3–6 крапель водного розчину аміаку та 2–3 краплі спиртового розчину диметилгліоксимату. Спостерігають випадання яскраво-червоного осаду диметилгліоксимату нікелю (внутрішньокомплексна сполука). Реакція ду-
же чутлива! Використовується для виявлення йонів Ni2+ у стічних водах.
Аналітичні реакції на йон Со2+ з нітратом калію
2–3 краплі розчину нітрату кобальту (ІІ) налити у пробірку, додати декілька крапель розчину СН3СООН до рН=3 (проба універсальним індикатором) та 1–2 краплі розчину нітрату калію. Випадає жовтий кристалічний осад K3[Co(NO2)6].
Co(NO3)2 + 7KNO2 + 2СН3СООН = K3[Co(NO2)6]↓ + NO +
+ 2KNO3 + 2СН3СООK + H2O
Co+2 +  + 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O
+ 3K+ + 2СН3СООН = K3[Co(NO2)6]↓ + NO + 2СН3СОО- + H2O
Реакція на йон Hg2+ із SnCl2
У пробірку до 0,5 мл розчину хлориду меркурію (ІІ) (сулеми) додати по краплям розчин SnCl2. Утворюється білий осад каломелю (Hg2Cl2), який поступово чорніє.
а) 2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4
2HgCl2 + Sn2+ = Hg2Cl2↓+ Sn4+ + 2Cl–
б) Hg2Cl2 + SnCl2 = 2Hg + SnCl4
Hg2Cl2 + Sn2+ = 2Hg + Sn4+ + 2Cl–
КОНТРОЛЬНІ ПИТАННЯ ДО КОЛОКВІУМІВ
ІII. АГРЕГАТНИЙ СТАН РЕЧОВИН
Робота: III. 1.
Визначення маси моля речовини вимірюванням її об’єму в газо-подібному стані.
Робота: III. 2.
Визначення в’язкості системи етиловий спирт – вода.
Ідеальний газ, умови його існування. Основні газові закони і умови їх застосування. Рівняння стану ідеального газу. Практичне застосування рівняння Менделєєва–Клапейрона. Реальні гази та умови їх існування. Рівняння стану реальних газів. Методика роботи і оформлення дослідних даних.
Загальна характеристика рідкого стану. В’язкість і текучість рідини. Одиниці вимірювання в’язкості. Основні рівняння гідродинаміки потоку Ньютона і Пуазейля, умови їх застосування. Причини відхилення від ламі-нарного потоку. Методи визначення в’язкості і фактори, що впливають на в’язкість. В’язкість розчинів високомолекулярних речовин. Методика робо-
ти і оформлення дослідних даних.
ІV. ХІМІЧНА ТЕРМОДИНАМІКА ТА БІОЕНЕРГЕТИКА
Робота: IV. 1.
Визначення теплоти горіння газів за допомогою калориметра Юнкерса.
Робота: IV. 2.
Визначення теплоти розчинення і теплоти гідратації солі.
Основні поняття і термінологія. Перший закон термодинаміки, його математичний вираз. Застосування першого закону термодинаміки до біологічних систем. Термохімія. Закон Гесса і висновки з нього. Стандарт-
ні теплоти (ентальпії) утворення, нейтралізації, згорання, розчинення. Термохімічні розрахунки. Методика виконання роботи та оформлення результатів.
V. ПОВЕРХНЕВІ ЯВИЩА (ПОВЕРХНЕВА ЕНЕРГІЯ, ПОВЕРХНЕВИЙ НАТЯГ ТА АДСОРБЦІЯ
НА МЕЖІ РОЗДІЛУ ФАЗ)
Робота: V. 1.
Визначення поверхневого натягу розчинів методом відліку кра-
пель (сталагмометричним методом)
Робота: V. 2.
Визначення площі та довжини молекули поверхнево-активної речовини
Робота: V. 3.
Адсорбція оцтової кислоти на активованому вугіллі
Робота: V. 4.
Дослідження адсорбції забарвлених речовин із розчинів
Робота: V. 5.
Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
Робота: V. 6.
Визначення повної обмінної ємності (оє) катіоніту
Робота: V. 7.
Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
Робота: V. 8.
Обезсолювання води за допомогою йонітів
Робота: V. 9.
Розділення йонів Fe3+, Cu2+, Co2+ методом хроматографії на оксиді алюмінію
Поверхневий натяг як питома поверхнева енергія на межі розділу двох фаз. Одиниці вимірювання поверхневого натягу. Фактори, що впливають на поверхневий натяг чистої рідини. Поверхнево-активні і поверхнево-неактивні речовини. Особливості будови їх молекул, приклади. Вплив по-
верхнево-активних речовин на величину поверхневого натягу води. Ізо-
терма поверхневого натягу. Зв’язок поверхневого натягу і адсорбції на межі розділу рідина – газ. Рівняння Гіббса. Позитивна і негативна адсорбція. Методи визначення поверхневого натягу. Фізико-хімічна суть йонооб-
мінної адсорбції. Вибіркова адсорбція. Правило Пескова – Панета – Фаянса. Йоніти. Обмінна ємність йонітів. Використання йонітів у медицині. Поняття про хроматографію. Методика визначення поверхневого натягу методом відліку крапель. Оформлення дослідних даних.
VІ. РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ
Робота: VI. 1.
Визначення критичної температури взаємного розчинення рідин
Робота: VI. 2.
Визначення молекулярної маси розчиненої речовини кріоскопіч-
ним методом
Загальна характеристика розчинів та їх практичне значення. Способи вираження концентрації розчинів. Розчинність у воді твердих, рідких та газоподібних речовин. Рівняння Сєчєнова та закон Генрі. Взаємна роз-чинність рідин. Критична температура розчинення рідин. Методика роботи і оформлення дослідних даних.
Закон Рауля. Кріоскопія та ебуліоскопія. Осмос, осмотичні явища. За-
кон Вант-Гоффа. Ізотонічні, гіпотонічні, гіпертонічні розчини. Плазмоліз, тургор. Оформлення результатів.
VІІ. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Робота: VIІ. 1.
Визначення електропровідності електролітів і обчислення ступеня дисоціації
Робота: VIІ. 2.
Визначення розчинності малорозчинних сполук
Робота: VIІ. 3.
Визначення іонного добутку води
Робота: VIІ. 4.
Визначення концентрації кислоти методом кондуктометричного титрування
Робота: VIІ. 5.
Визначення вмісту лікарської речовини в розчині
Теорія електролітичної дисоціації. Ступінь дисоціації. Сильні та слабкі електроліти. Електростатична теорія сильних електролітів (теорія Дебая–Гюккеля), основні положення теорії. Йонна сила розчину. Провід-
ники першого і другого роду. Фактори, що впливають на величину елек-
тропровідності сильних та слабких електролітів. Загальна, питома та еквівалентна електропровідність, їх значення. Електроліти в організмі людини. Рідини і тканини організму як провідники другого роду. Суть кон-
дуктометричного титрування. Закономірності кондуктометричного титру-
вання. Вимірювання електропровідності. Методика експерименту та роз-
рахункові формули.
VІІІ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ ТА ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ
Робота: VIІІ. 1.
Вимірювання електрорушійної сили гальванічного елемента
Робота: VIІІ. 2.
Визначення водневого показника потенціометричним методом
Робота: VIІІ. 3.
Потенціометричне визначення рН, розрахунок константи дисо-
ціації слабкої кислоти
Виникнення електродного потенціалу на межі метал–розчин його солі. Залежність величини потенціалу від природи металу, концентрації йонів даного металу в розчині і від температури. Формула Нернста для елек-
тродного потенціалу. Електроди порівняння. Нормальний водневий і кало-
мельний електроди, їх будова і виникнення потенціалу. Нормальні потен-
ціали. Ряд напруг. Дифузійні потенціали. Теорія гальванічного елементу. Зворотні і незворотні гальванічні елементи, концентраційні, хімічні та окисно-відновні гальванічні ланцюги. Елемент Вестона, його будова і застосування. Компенсаційний метод визначення ЕРС: електрична схема. Визначення потенціалів окремих електродів. Водневий електрод, утво-
рення потенціалу і його залежність від концентрації водневих йонів. Нор-
мальний потенціал водневого електроду. Хінгідронний та скляний елек-
троди. Визначення концентрації водневих йонів за допомогою хінгід-ронно-каломельного ланцюга. Вода як слабкий електроліт. Йонний до-
буток води, його практичне значення. Концентрація водневих йонів і водневий показник, їх взаємозв’язок. Методи вимірювання рН. Буферні системи та їх властивості. Приклади буферних систем. Механізм дії буферних систем. Поняття про буферну ємність і фактори, що визначають буферну ємність. Лужний резерв крові. Біологічне значення буферних систем. Методика експерименту.
Оформлення дослідних даних.
IX. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
Робота: IX. 1.
Визначення швидкості розкладу тіосульфатної кислоти
Робота: IX. 2.
Каталітичний вплив йонів феруму на швидкість окислення йодис-товодневої кислоти персульфатом амонію
Робота: IX. 3.
Дослідження гідролізу крохмалю в присутності соляної кислоти
Робота: IX. 4.
Дослідження гідролізу крохмалю в присутності ферментів і соля-
ної кислоти при температурі 310 К
Робота: IX. 5.
Визначення швидкості розкладу пероксиду водню газометричним методом
Робота: IX. 6.
Фотохімічний розклад Н2О2
Швидкість реакції та фактори, що впливають на неї. Молекулярність та порядок реакції. Константа швидкості для односторонніх реакцій першого і другого порядків. Вплив температури на швидкість хімічних реакцій. Закон Вант-Гоффа. Температурні межі життя. Рівняння Арреніуса. Енергія активації та її визначення. Каталіз і каталізатори. Гомогенні та гетерогенні каталітичні процеси. Ферменти як біологічні каталізатори. Особливості кінетики ферментативних процесів. Механізм хімічних та біохімічних реакцій. Фотохімічні реакції.
Х. ФІЗИКОХІМІЯ ДИСПЕРСНИХ СИСТЕМ
Робота: Х. 1.
Методи одержання колоїдних розчинів
Робота: Х. 2.
Коагуляція колоїдних розчинів електролітами
Робота: Х. 3.
Визначення величини електрокінетичного потенціалу методом електрофорезу
Колоїдно-дисперсні системи. Класифікація дисперсних систем. Елек-
тричні, оптичні та молекулярно-кінетичні властивості дисперсних систем. Методи одержання колоїдних розчинів. Будова міцели ліофобного золю. Стійкість ліофобних золів, причини їх коагуляції. Вплив електролітів на коагуляцію ліофобних золів. Поріг коагуляції. Правило Шульца-Гарді. Подвійний електричний шар. Теорії будови подвійного електричного ша-
ру. Виникнення електрокінетичного потенціалу, фактори, що впливають на його величину. Методи визначення електрокінетичного потенціалу. Мето-
дика виконання роботи і оформлення дослідних даних.
Робота: Х. 4.
Вивчення ізоелектричної точки білків
Причини, що зумовлюють гідрофільні та амфотерні властивості моле-
кули білка. Вплив концентрації водневих йонів Н+ на дисоціацію білків. Ізоелектричний стан. Вплив електролітів на положення ізоелектричної точки казеїну. Особливості ізоелектричного стану ліофільних золей. Зміна властивостей молекули білка в ізоелектричній точці. Методика роботи.
Робота: Х. 5.
Набухання гелів
Гелі, методи одержання. Відмінність крихких гелів від студнів. Набу-
хання гелів, обмежене і необмежене набухання. Фактори, що впливають на ступінь набухання. Явища, якими супроводжується набухання (тиск та теплота набухання). Методика виконання роботи.
ХІ. БІОГЕННІ ЕЛЕМЕНТИ
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 474; Нарушение авторских прав?; Мы поможем в написании вашей работы!