
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 1 страница
|
|
|
|
Роботу починають з приготування розчинів із відомою питомою електропровідністю і тих, питому електропровідність яких потрібно виз-
начити. Концентрація задається викладачем.
З 1 н. розчину КСl або NaCl шляхом розведення готують розчини, вказані керівником занять. Не слід готувати всі розчини безпосередньо з
1 н., оскільки помилки при вимірюванні його об’єму ведуть до великої помилки в концентрації приготовленого розчину. Для розведення слід брати розчин попередньої концентрації.
Після того, як всі розчини приготовлені, складають електричну схему. Джерело струму не вмикають, поки схему не перевірить керівник занять або лаборант. Якщо схема працює, приступають до вимірювань величини опо-
ру. Вимірювання опору починають від дистильованої води, найбільш розве-
дених розчинів, переходячи до концентрованих. Порядок вимірювань на-
ступний. Посудину для визначення електропровідності та електроди ста-
ранно промивають дистильованою водою. Після цього заливають у по-
судину 20–25 мл дистильованої води (оскільки вимірювання починають
з води).
Одягнувши навушники, або по розгортці екрану осцилографа контакт ставлять приблизно посередині лінійки (0,25–0,30 м). Ввімкнувши струм, на магазині опору підбирають такий опір, при якому в навушниках звук буде мінімальним (точка на екрані). Рекомендується при підбиранні опору користуватися одним каскадом. При цьому слід пам’ятати, що чим більш розведений розчин, тим менша його загальна електропровідність, тобто більший опір. Отже, щоб компенсація була на середині лінійки, очевидно, на магазині необхідно брати більші опори. Із збільшенням концентрації опір, який підбирається на магазині, знижується. Досягнувши мінімуму звуку в навушниках, точнішу компенсацію здійснюють за допомогою пересувного контакту на реохорді.
Не виливаючи розчину, міняють опір магазину на 10% у більшу і меншу сторону і визначають положення контакту для цих випадків, тобто для кожного розчину проводять три визначення для знаходження серед-
нього з величин опору. Якщо при будь-якому положенні контакту не спостерігається мінімального звуку, або точки на екрані осцилографу, то необхідно перевірити правильність з’єднань у загальній схемі, в кожній вітці окремо.
Користуючись результатами досліду, можна розрахувати опір і елек-
тропровідність розчинів, ємність опору посудини, питому і еквівалентну електропровідність, ступінь дисоціації, константу дисоціації. Ведуть розра-
хунки тих величин, які вказані в завданні.
Питома електропровідність водних розчинів KCl та NaCl при 298 К наведена в табл. 1.
Таблиця 1
| Концентрація, моль×екв./м3 | c, м × Ом–1 | |
| KCl | NaCl | |
| 0,5 | 0,0005940 | 0,0004681 |
| 0,2 | 0,0002484 | 0,0002034 |
| 0,1 | 0,0001288 | 0,0001067 |
| 0,5 | 0,00006668 | 0,00005553 |
| 0,02 | 0,00002767 | 0,00002315 |
| 0,01 | 0,00001413 | 0,00001185 |
| 0,005 | 0,000007177 | 0,000006032 |
| 0,002 | 0,000002526 | 0,000002112 |
| 0,001 | 0,000001496 | 0,000001237 |
Опір розчинів або води розраховують, користуючись виразом:
 . .
| (1) |
Звідки
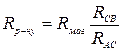 . .
|
З середніх значень опорів розраховують їх середні електро-
провідності
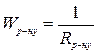
| (2) |
Користуючись залежністю питомої електропровідності від загальної 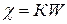 , де c – питома електропровідність, яку можна розрахувати, якщо відомий коефіцієнт пропорційності К, який є константою (ємністю опору) посудини, в якій проводяться вимірювання. Величина його залежить від площі електродів, відстані між ними, від форми посудини та інших факторів.
, де c – питома електропровідність, яку можна розрахувати, якщо відомий коефіцієнт пропорційності К, який є константою (ємністю опору) посудини, в якій проводяться вимірювання. Величина його залежить від площі електродів, відстані між ними, від форми посудини та інших факторів.
Згідно формулі 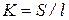 , де S – площа електроду, l – відстань між ни-
, де S – площа електроду, l – відстань між ни-
ми. Константу К розраховують, користуючись рівнянням (3), враховуючи при цьому поправку на електропровідність розчину, приготованого на дистильованій воді.
Електропровідність води розраховують за формулами (1), (2). Якщо  – величина дуже мала, порівняно з Wр-ну, то при розрахунках величини К нею нехтують.
– величина дуже мала, порівняно з Wр-ну, то при розрахунках величини К нею нехтують.
Тоді
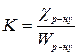 . .
| (3) |
Щоб скористатися формулою (3), необхідно знати значення питомої електропровідності c. Для цього загальну електропровідність визначають з досліду, а питому беруть з табличних даних.
Для визначення ємності електропровідності (К) використовують три розчини KCl або NaCl. Концентрації їх вказує керівник занять. Питому електропровідність для цих розчинів беруть з таблиць.
Знаючи константу посудини, можна розрахувати питому електропро-
відність будь-якого розчину, загальну електропровідність якого визна-
чають у цій посудині:
 . .
| (4) |
Знаючи питому електропровідність, розраховують еквівалентну
lр-ну, використовуючи формулу їх взаємозв’язку
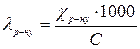 , ,
| (5) |
де С – концентрація розчину виражена в моль×екв./л.
Аналогічно визначають еквівалентну електропровідність при розве-
денні l¥. За безмежне розведення беруть концентрацію 0,0001 н. розчинів.
Знаючи l¥ і l при даному розведенні, розраховують ступінь дисоціації
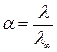 . .
| (6) |
Користуючись законом розведення Оствальда можна розрахувати константу дисоціації слабкого електроліту, підставляючи (6)
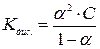 . .
| (7) |
Величина α слабких кислот та основ у не дуже розбавлених розчинах дуже мала, і нею в знаменнику (7) можна знехтувати, приймаючи  за 1. Тоді одержуємо:
за 1. Тоді одержуємо:

або
 . (8)
. (8)
Це рівняння дає змогу вирахувати ступінь електролітичної дисоціації слабкого електроліту в розчині відомої концентрації, якщо відома константа Кдис.
Вищевказані закономірності придатні для слабких електролітів. Однак при малих концентраціях вони придатні і для сильних.
Визначення електропровідності за допомогою моста Р 38.
 |
Передня панель мосту має такий вигляд:
Робота на змінному струмові
1. Підвести до гнізд приладу напругу 220 В з частотою 50 Гц і перемикач “Питание” поставити в положення ”~”.
2. Перемикач важеля порівняння вставити в положення “Установ-
ка нуля” і встановити перемикач “Гальв.” у положення “Точно” обертанням коректору на гальванометрі, встановивши стрілку в нульове положення.
3. Встановити перемикач “Гальв.” у положення “Грубо” і зрівно-
важити міст обертанням рукояток важеля порівняння і реохор-
ду, потім перевести перемикач “Гальв.” у положення “Точно” і обертанням рукоятки реохорду дорівноважити міст.
4. Вимірювання електролітів на підвищеній частоті до 500 Гц проводиться таким же чином, як і на частоті 50 Гц.
Результати досліду і обрахунків записуються в табл. 2:
Таблиця 2
| Концен-трація, кмоль×екв/м3 | Опір розчину, Ом | Середн. опір розчину, Ом | Середн. електро- провід. Розчину, Ом | Ємніс. опору посуд., м | c, Ом–1×м–1 | l,

| a | Кдис |
На основі даних побудувати графічні залежності 
 .
.
2. BИЗНАЧЕННЯ РОЗЧИННОСТІ МАЛОРОЗЧИННИХ СПОЛУК
Для виконання цієї роботи дуже зручно використати хлорид срібла. З цією метою невелика кількість (2-5 г) добре розтертої солі переносять у колбу і декантацією промивається дистильованою водою. Після промивання знову заливається дистильована вода обережно (без струшування) до прозорості розчину і замірюється опір розчину.
Оскільки сіль AgCl дуже погано розчинна, то ступінь її іонізації у водному розчині наближається до одиниці, тобто молярна електропровідність насиченого розчину цієї солі практично не відрізняється від граничної електропровідності –
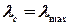
 ,
,
де S – розчинність хлориду срібла,
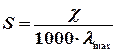 .
.
Експериментально встановлено, що питома електропровідність насиченого розчину хлориду срібла дорівнює 3,40×10-4см.м-1.Оскільки вода сама є слабим електролітом, то слід враховувати її власний внесок у електропровідність розчину (c води 1,60.10-4см.м-1). Таким чином,
 .
.
Користуючись нижче приведеною таблицею, величина граничної молярної електропровідності хлориду срібла:
 , тоді розчинність хлориду срібла
, тоді розчинність хлориду срібла
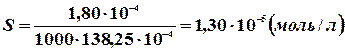
ЕЛЕКТРОЛІТИЧНА РУХЛИВІСТЬ ІОНІВ
У ВОДНИХ РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
при 298 К (lі, см.моль-1.м2)
| Катіони | l+.104 | Аніони | l-.104 |
| H3O+ | 349,81 | OH- | 198,30 |
| Li+ | 38,68 | F- | 55,40 |
| Na+ | 50,10 | Cl- | 76,35 |
| K+ | 73,50 | Br- | 78,14 |
| Ag+ | 61,90 | I- | 76,88 |
| NH4+ | 73,50 | NO32- | 71,46 |
| Mg2+ | 53,05 | HCO3- | 44,50 |
| Ca2+ | 59,50 | CH3COO- | 40,90 |
| Ba2+ | 63,63 | SO42- | 80,02 |
| Cu2+ | 56,60 | HCOO- | 54,60 |
| Zn2+ | 52,80 | C6H5COO- | 32,30 |
| Al2+ | 63,00 | C2H42- | 74,10 |
Оскільки хлорид срібла – бінарний електроліт, то [ Ag+] = [ Cl-]. Знаючи концентрацію іонів, можна визначити добуток розчинності
 .
.
Аналогічно визначається розчинність та добуток розчинності інших важкорозчинних сполук.
Результати досліду і розрахунків записуються в таблицю:
| Концен-трація | Опір розчину, Ом | Середній опір, Ом | Середня електро-пров. р-ну | Ємність опору посуди- ни | c | l | ДР |
3. ВИЗНАЧЕННЯ ІОННОГО ДОБУТКУ ВОДИ
Для роботи необхідно: реохорд АВС; звуковий генератор ЗГ; на-
вушники Т або осцилограф; посуд для визначення електропровідності і платинові електроди Б; мірна колба на 50–100 мл; піпетки мірні; магазин опору.
Для виконання цієї роботи використовується рівняння
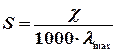 .
.
Наприклад, при 291 К питома електропровідність чистої води дорівнює 4,41.10-6см.м-1. За даними таблиці, приведеної в попередній роботі, знаходимо
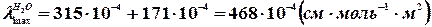 .
.
Одержавши концентрацію іонів Н+ та ОН-
 ,
,
визначаємо іонний добуток води при 291 К:
 .
.
Аналогічно визначається величина іонного добутку води при інших температурах. Результати експерименту та розрахунків записуються у вигляді таблиці:
| Концен-трація | Опір розчину, Ом | Середній опір, Ом | Середня електро-пров. р-ну | Ємність опору посуди- ни | c | l | Кw |
4.ВИЗНАЧЕННЯ КОНЦЕНТРАЦІЇ КИСЛОТИ МЕТОДОМ КОНДУКТОМЕТРИЧНОГО ТИТРУВАННЯ
Для роботи необхідно: 1н.; 0,1н. розчини NaOH; контрольний розчин кислоти; піпетка на 20–25 мл; мікропіпетка; провідники електричні – 5 шт.
В об’ємному аналізі для визначення кінця титрування застосовують кольорові індикатори. Ці індикатори можуть бути використані в тих ви-
падках, коли необхідно титрувати забарвлені або мутні розчини, так як на фоні цих розчинів зміну кольору індикатора визначити неможливо.
У таких випадках особливо часто при нейтралізації слабких кислот і лугів “індикатором” служить електропровідність розчинів.
Вимірювання електропровідності розчинів знайшло широке прак-
тичне застосування. Одним з них являється кондуктометричне титрування. Суть методу полягає в тому, що в процесі титрування одні йони в розчині заміняються іншими, рухливість яких інша, а відповідно змінюється і електропровідність розчину.

Рис. 1. Електрична схема для кондуктометричного титрування.
Визначаючи електропровідність розчину, можна розрахувати його кон-центрацію.
Оскільки електропровідність є величина обернена опорові, то для її визначення достатньо знайти опір розчину струмові, який проходить через нього. Опір визначається компенсаційним методом із застосуванням мос-
тика Кольрауша, схема якого подана на рис.1, де АВС – реохорд; R – магазин опорів; Т – навушники або осцилограф; Б – посуд з розчином електроліту, електропровідність якого необхідно визначити; ЗГ – звуковий генератор; К – ключ.
При замиканні кола ключем струм від джерела струму розгалужу-
ється, утворюючи 4 гілки опору: RAC,RCB,Rр-ну, Rмаг.
У навушниках чується звук, а на екрані осцилографа спостерігається лінія. При переміщенні контакту по реохорду в одному і другому напрямах звук то посилюється, то послаблюється, лінія на екрані змінюється за величиною.
У момент, коли  , струм у мостику СД відсутній, що вияв-
, струм у мостику СД відсутній, що вияв-
ляється повним зникненням звуку в навушниках, на екрані осцилографа буде точка.
Виходячи з поданого вище рівняння, можна визначити опір розчину
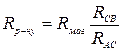 .
.
Знаючи опір розчину, розраховують електропровідність по формулі
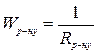 .
.
При визначенні електропровідності користуються слабими струмами високої частоти: з цією метою використовується звуковий генератор.
Посуд, в який заливається розчин (електропровідність якого треба визначити), являє собою склянку з платиновими електродами (рис. 2). Для уникнення поляризації поряд з використанням струмів високої частоти збільшують поверхню електродів. З цією метою електроди платинуються.
 У склянку заливають 20–25 мл контрольного роз-
У склянку заливають 20–25 мл контрольного роз-
чину кислоти і опускають електроди в кислоту. Поста-
вивши рухомий контакт на поділках 0,25–0,3 м на реохорді, включають струм, користуючись ключем К.
У такому положенні підбирають за допомогою магазину опору такий опір, при якому струм через навушники не проходить, тобто звук у навушниках відсутній або стає мінімальним, або на екрані осцилографа світиться точка.
Залишаючи опір магазину постійним при всіх наступних вимірюваннях, мікропіпеткою приливають порціями розчин NaOH. (Кількість розчину і концен-трація розчину NaOH вказується керівником занять).
Розчин у стаканчику помішують і рухомим контак-
том знову знаходять мінімум звуку.
Мінімум звуку або точка на екрані з додаванням кожної порції лугу зміщується вліво до тих пір, поки кислота не буде повністю відтитрована. Після точки нейтралізації електропровідність розчину зростає, і тому ру-
хомий контакт необхідно зміщувати вправо по лінійці.
Дослід вважається закінченим, коли одержано 5–6 вимірювань після точки нейтралізації.
Результати вимірювань записують у вигляді наступної таблиці:
| Кіль-кість к-ти, мл | Конц. NaOH, моль×екв/л | Кіль- кість NaOH, мл | Опір маг., Ом | Покази на лінійці, м | Опір розчину, Ом | Електро-провід. розчину, Ом–1 | |
| АС | СВ | ||||||
По даним таблиці будують графік залежності електропровідності розчину від кількості лугу, яка пішла на титрування кислоти. По графіку знаходять кількість розчину NaOH, необхідну для нейтралізації взятої кількості кислоти і за формулою  знаходять концентрацію контрольного розчину кислоти
знаходять концентрацію контрольного розчину кислоти  ,
,
де N1 – невідома концентрація кислоти;
V1 – об’єм кислоти, взятий для досліду;
N2 – концентрація розчину лугу;
V2 – об’єм лугу, необхідний для відтитрування кислоти.
5. ВИЗНАЧЕННЯ ВМІСТУ ЛІКАРСЬКОЇ РЕЧОВИНИ В РОЗЧИНІ
Для роботи необхідно: міст змінного струму; термостат (298  0,1К); кондуктометрична комірка з платиновими електродами (константа комірки відома); 4–5 мірних колб на 100 мл; 4–5 стаканів тієї ж місткості; розчини сильних електролітів, які застосовуються в фармації: соляна кислота, бен-
0,1К); кондуктометрична комірка з платиновими електродами (константа комірки відома); 4–5 мірних колб на 100 мл; 4–5 стаканів тієї ж місткості; розчини сильних електролітів, які застосовуються в фармації: соляна кислота, бен-
зоат, саліцілат, гідрокарбонат натрію; сульфат магнію або хлорид кальцію, дистильована вода; аналітичні ваги; розчин реагенту НСl концентрації
2×10–2моль/л; 4–5 конічних колб з пробками; об’єкти дослідження: амідо-
пірин, стрептоцид або бензоат натрію у вигляді чистих фармакопейних препаратів і таблеток.
Мета роботи: виміряти опір системи розчину реагенту; внести точну наважку досліджуваної речовини; виміряти опір розчину; розрахувати питому електричну провідність та її зміну; одержати калібрований графік або його рівняння; визначити склад речовини у вихідній таблетці.
Пряме кондуктометричне визначення вмісту лікарської речовини в слабких електролітах практично неможливе. Абсолютні величини χ слаб-
ких електролітів малі, залежність  має нелінійний характер. Дода-
має нелінійний характер. Дода-
вання досліджуваної речовини у розчин реагенту, що з ним взаємодіє, викликає зміну питомої електричної провідності розчину, яка при визна-
чених умовах пропорційна концентрації цієї речовини. Такий метод називають прямою кондуктометрією з хімічним впливом на систему.
Наведемо приклад прямого кондуктометричного аналізу слабких основ. В якості реагенту застосовують розчин слабкої кислоти НА відомої концентрації ср; його питома електрична провідність 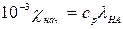 . Після додавання слабкої основи ВОН з концентрацією со при умові со<ср проходить нейтралізація згідно реакції
. Після додавання слабкої основи ВОН з концентрацією со при умові со<ср проходить нейтралізація згідно реакції
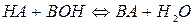
В одержаному розчині знаходиться утворена сіль ВА в концентрації со і надлишок реагенту НА в концентрації ср – со. На основі адитивності знаходимо питому електричну провідність одержаного розчину (χ):
 (1)
(1)
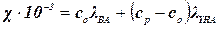 (2)
(2)
По рівнянню реакції замість сильної кислоти НА утворюється екві-
валентна маса солі ВА, тому концентрація розчину не міняється, різниця йонних еквівалентних електричних провідностей 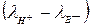 є величина постійна, а зміна питомої електричної провідності розчину прямо про-
є величина постійна, а зміна питомої електричної провідності розчину прямо про-
порційна концентрації досліджуваної слабкої основи рівняння (2).
На практиці в розчин реагенту вносять певні маси досліджуваної речовини, кожний раз визначаючи Δχ. Будують лінійний графік 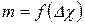 , де m – маса речовини, або одержують рівняння
, де m – маса речовини, або одержують рівняння
 . (3)
. (3)
Коефіцієнти а і b знаходять методом найменших квадратів.
Пряма кондуктометрія з хімічним впливом на систему враховує швид-
кість прямого кондуктометричного методу з можливостями кондукто-
метричного титрування. У цьому методі можуть використовуватись не тільки реакції нейтралізації, але й осадження, витіснення із солей, комп-
лексоутворення. Домішки стороннього електроліту (до 3–4%) у меншій мірі заважають проведенню аналізу, чим у класичному варіанті прямої кондуктометрії.
Для успішного проведення аналізу взаємодія повинна йти швидко і до кінця, продукти реакції і реагент повинні мати максимально різні екві-
валентні електричні провідності. Відношення концентрацій речовини, що визначають, і реагенту повинно бути в межах 0,5–0,95, так як зростає похибка аналізу із-за зменшення Δχ.
Хід роботи
В 4–5 конічних колб вносять точні маси чистого препарату, до-
дають із бюретки по 50 мл НСl визначеної концентрації. Маси розра-
ховують так, щоб відношення концентрації речовини, що визначають, і реагенту знаходилось в межах 0,5–0,95. Розчини перемішують і вимірюють опір чистого реагенту НСl і всіх розчинів при Т=298 К. Таблетку неві-
домого складу зважують, потім подрібнюють до порошку і вносять в чис-
тий розчин реагенту (50 мл), повністю розчиняють (дозволяється каламут-
ність нерозчинних домішок). Іноді потрібен підігрів розчину на водяній бані. Вимірюють опір одержаного розчину.
Обробка результатів експерименту
Для кожного розчину розраховують за рівнянням опір  і зміну питомої електричної провідності Δχ по рівнянню (1), будують залеж-
і зміну питомої електричної провідності Δχ по рівнянню (1), будують залеж-
ність 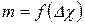 і методом найменших квадратів розраховують коефі-
і методом найменших квадратів розраховують коефі-
цієнти а і b рівняння (3). Розраховують χ і Δχ у досліді з таблеткою і за каліброваним графіком або рівнянням (3) знаходять масу речовини в таблетці, що аналізується. Оцінюють похибку аналізу, підставивши у рівняння (3) величини Δχ і зрівнявши взяті наважки з розрахованими по рівнянню.
Результати досліду і розрахунки заносять у таблицю:
| №п/п | Маса наважки т, кг | Опір R, Ом | Питома електрична провідність χ, Ом–1×м–1 | Зміна питомої електричної провідності, Δχ, Ом–1×м–1 |
VIII. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ ТА ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ
1. ВИМІРЮВАННЯ ЕЛЕКТРОРУШІЙНИХ СИЛ ГАЛЬВАНІЧНИХ ЕЛЕМЕНТІВ
Для роботи необхідно: акумулятор на 1,2 V – Ак; гальванометр – Г; нормальний елемент Вестона Еп; елемент з невідомою ЕРС – Ех; реохорд АВ; ключ для вмикання К; перемикач на шість клем П; провідники струму; розчини CuSO4, ZnSO4; насичений розчин KCl.
Прилад, в якому відбувається перетворення хімічної енергії в елек-
тричну, називається гальванічним елементом. Його можна зобразити схе-
мою
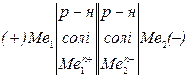
ЕРС такого елемента в більшості випадків виміряють двома мето-
дами: ввімкненням у ланцюг чутливого вольтметра або компенсаційним методом. Перший з цих методів має деякі недоліки, зв’язані з проход-
женням через прилад електричного струму. Ці недоліки усуваються при визначенні ЕРС компенсаційним методом, коли через елемент струм не проходить.

Схема установки для вимірювання ЕРС
компенсаційним методом.
Принцип методу компенсації полягає в тому, що до елемента з невідо-
мою ЕРС приєднують інший елемент, ЕРС якого направлена назустріч (джерело струму). При цьому відбувається взаємна компенсація двох електрорушійних сил – досліджуваного елемента і джерела струму.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 648; Нарушение авторских прав?; Мы поможем в написании вашей работы!