
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Результати титрування 1 страница
|
|
|
|
Виконання роботи
Попередньо готують по 300 мл водних розчинів: 1) 0,12 н. КІ; 2) 0,025 н. Н2SO4; 3) 0,0005 н. СuSO4 (0,062 г/л СuSO4 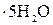 ); 4) 0,0005 н. FeSO4
); 4) 0,0005 н. FeSO4
(0,07 г/л FeSO4×7H2O); 5) 0,1 н. (NH4)2S2O8. Всі ці розчини з дистильо-
ваною водою ставлять у термостат, температура якого 298 К.
Одночасно у холодильник або в сніг ставлять дистильовану воду.
За допомогою піпеток готують реакційні суміші, як зазначено в табл. 1.
У всіх трьох випадках останнім вливають в розчин йодид калію. Мо-
мент вливання йодиду калію (внаслідок чого утворюється НІ) вважають початком реакції. Суміш у кожній колбі швидко розмішують і ставлять у термостат.
Таблиця 1
Склад реакційної суміші
| № реак-ційної суміші | Об’єм розчину в суміші, 10-6 м3 | |||||
| Дистильо-вана вода | (NH4)2S2O8 | Н2SO4 | СuSO4 | FeSO4 | КІ | |
| - | - | |||||
| - | ||||||
| - |
Через 3, 6, 10, 20, 40, 60 хв. відбирають по 20 мл суміші, вливають у конічну колбу на 250 мл, в яку добавляють приблизно 100 мл охолодженої води, і титрують 0,01 н. розчином тіосульфату натрію при наявності крох-
малю. Момент відбирання проби відмічають точно за годинником. Титру-
вання дає змогу визначити кількість йоду, що утворився при реакції.
Результати титрування заносяться у табл. 2.
Таблиця 2
| № розчину | Об’єм розчину Nа2S2O8, що пішов на титрування проби, мл, відібраної через певний час, с | |||||
За даними експерименту будують графік у координатах: об’єм роз-
чину тіосульфату натрію, що пішов на титрування (мл), час (хв), на основі яких оцінюють каталітичний вплив йонів міді та феруму.
3. ДОСЛІДЖЕННЯ ГІДРОЛІЗУ КРОХМАЛЮ
В ПРИСУТНОСТІ СОЛЯНОЇ КИСЛОТИ
Для роботи необхідно: 10% розчин НСl; 10% розчин NaOH; крохмаль; 1% розчин CuSO4; глюкоза; штатив з пробірками; колби на 250 мл; спиртівка.
У колбу із зворотним (повітряним) холодильником налити 30 мл 1% розчину крохмалю, додати 15 мл 10% розчину соляної кислоти, довести до кипіння і кип’ятити протягом 10 хвилин. Обережно охолодити колбу проточною водою. Із вмістом колби (гідролізатом) проробити реакції: а) на крохмаль; б) на глюкозу (реакція Тромера).
а) Відібрати в чисту пробірку 10 крапель гідролізату і додати 1–2 краплі йоду. Поява синього кольору вказує на наявність крохмалю (реакція позитивна), відсутність синього кольору вказує на те, що відбувся гідроліз крохмалю і утворилися продукти гідролізу – мальтоза (реакція негативна).
б) У пробірку налити 5 крапель гідролізату, додати 8 крапель 10% розчину NaOH і сульфату купруму CuSO4 (1% розчин) до появи осаду гідроксиду міді (ІІ) блакитного кольору. Пробірку нагріти на полум’ї пальника. Поява жовтого кольору, що переходить у червоний, свідчить про наявність продуктів гідролізу крохмалю – мальтози і глюкози.
4. ДОСЛІДЖЕННЯ ГІДРОЛІЗУ КРОХМАЛЮ В ПРИСУТНОСТІ ФЕРМЕНТІВ І СОЛЯНОЇ КИСЛОТИ ПРИ ТЕМПЕРАТУРІ 310 К
Для роботи необхідно: розчин крохмалю; розчини ферментів; водяна баня; штатив з пробірками; спиртовий розчин йоду; розчин соляної кислоти.
У 5 пробірок налити по 2 мл розчину крохмалю. В 1 пробірку додати
1 мл слини (або іншого ферменту), розведеної в 2 рази, в 2 – розведеної в
4 рази, в 3 – в 8 раз, в 4 – 1 мл соляної кислоти, в 5 – 1 мл води (5 пробірка служить контролем). Усі пробірки поставити у водяну баню при тем-
пературі 310 К на 10 хвилин. Після охолодження вміст кожної з них розлити у 2 чисті пробірки і проробити реакції на крохмаль з йодом і реакцію Тромера, аналогічно а), б) ІХ.3.
Результати досліджень занести в таблицю:
| № п/п | Субстрат | Ката- лізатор | Темпе-ратура, К | Реакція на крохмаль | Реакція Тромера | Чи відбувається гідроліз? |
5. ВИЗНАЧЕННЯ ШВИДКОСТІ РОЗКЛАДУ ПЕРОКСИДУ ВОДНЮ ГАЗОМЕТРИЧНИМ МЕТОДОМ
Для роботи необхідно: Установка (рис.1.), перексид водню, термостат.
Пероксид водню в водних розчинах повільно розкладається по рівнянню:
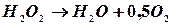 .
.
У присутності катіонів і аніонів деяких органічних речовин, а також ряду твердих речовин розклад перекису водню значно прискорюється. Тому ця реакція у водних розчинах може бути гомогенною або гетерогенною каталітичною реакцією в залежності від взятого каталізатору.
За ходом реакції спостерігають по зміні об’єму кисню, що виділяється через різні проміжки часу від початку реакції.
ПОСЛІДОВНІСТЬ ВИКОНАННЯ РОБОТИ.
 Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.
Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.
Після 30 хвилин термостатування в реакційну посудину налити певну кількість пероксиду водню. Розчин ретельно розмішати скляною паличкою і реакційну посудину закрити корком.
Верхній кран на протязі 1-2 хв. тримати відкритим (для витіснення повітря, що виділяється киснем з реакційної посудини), потім його закрити, з’єднавши таким чином реакційну посудину з газовою бюреткою. Встановити одинакові рівні рідини в бюретці і зрівняльній склянці, провести перший вимір і записати рівень на бюретці і час. Кожна послідуюча зміна супроводжується таким записом, причому рівень рідини в бюретці і зрівняльній склянці підтримують одинаковим. Рівень рідини в бюретці записується через 2-5 хв. (чим вище температура, тим менший час між вимірами). Після того, як реакція практично припиниться, реакційну посудину помістити в киплячу водяну баню і витримати в ній до повного розкладу пероксиду водню (біля 30 хв.). Реакція вважається закінченою, якщо рівень газу в бюретці перестає змінюватись. При кип’ятінні на водяній бані зрівняльну склянку тримають у найбільш високому положенні.
Після повного розкладу пероксиду водню реакційну посудину охолодити до температури термостату, витримати в ньому на протязі 25-30 хв. і при одинакових рівнях рідин у бюретці і в зрівняльній склянці заміряти рівень рідини в бюретці.
При обробці експериментальних даних за початок реакції приймати третій або четвертий вимір (тобто вимірювання в умовах режиму, що встановився). Визначають інтервал часу від початку реакції до кожного послідуючого вимірювання t і об’єми кисню, що виділився при проходженні цих інтервалів аt.
По одержаних даних побудувати графіки залежності:
1.Рівності об’ємів кисню від часу (час у хвилинах).
 .
.
2.Тобто 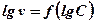 , по якому знаходять порядок реакції.
, по якому знаходять порядок реакції.
3.Логарифму швидкості реакції через різні проміжки часу від логарифму різниці об’ємів кисню, що виділився 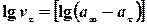 .
.
Далі проводять обрахунок величини константи швидкості реакції за рівнянням
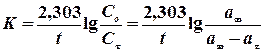 ,
,
де а¥ - об’єм кисню, що виділився після розкладу пероксиду водню (визначається як різниця рівней у бюретці в момент, прийнятий за початок реакції, і після кипіня Н2О2 до повного розкладу). Результати представити у вигляді 4-х графіків і таблиці.
Температура досліду___________
Каталізатор___________________
Кількість перекису водню_______
| № вимі-рювань | Час вимі-рюваня, с | Час від початку реакції, с | Рівень рідини в бюретці, мл | Об’єм газу, що виділи-вся, м3 | Швид-кість реакції | 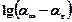
| 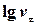 
| 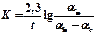
| К |
6. ФОТОХІМІЧНИЙ РОЗКЛАД Н2О2
Для роботи необхідно: установка (рис.1), перексид водню.
Фотохімічний розклад Н2О2 являється типовим ланцюговим процесом, механізм якого можна представити таким чином:
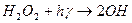 - реакція зародження ланцюга;
- реакція зародження ланцюга;
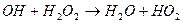 - цикл регенерації;
- цикл регенерації;
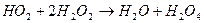
 - реакція розгалуження;
- реакція розгалуження;
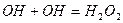 - реакція обриву ланцюга.
- реакція обриву ланцюга.
Виділення кисню відбувається в результаті реакції
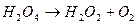
Ця реакція відноситься до ланцюгових реакцій з „виродженими розгалуженнями”. В даному процесі розгалуження здійснюється фотохімічно за рахунок підводу енергії ззовні. Відносно стійким проміжним продуктом являється вільний радикал ОН-. Кінетика цієї реакції виражається рівнянням: 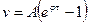 , де
, де
φ - константа наростання, що характеризує швидкість розгалуження;
τ – час.
Логарифмування його дає 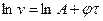 . Це рівняння прямої в системі координат
. Це рівняння прямої в системі координат 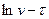 .
.
Перед початком роботи необхідно по термодинамічним функціям розрахувати теплові ефекти елементарних стадій реакції та оцінити принципову можливість їх здійснення. Робота проводиться на установці, схема якої приведена на рис.1.
Послідовність виконання роботи
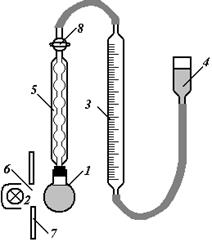 Рис. 1. Схема установки для вивчення кінетики фотохімічного розкладу Н2О2
Рис. 1. Схема установки для вивчення кінетики фотохімічного розкладу Н2О2
|
Установка складається з кварцової колби 1, яка пропускає ультрафіолетові промені, зворотнього холодильника 5, градуйованої газової бюретки 3, зрівнювальної склянки 4 та ртутнокварцевої лампи 2. Кварцеву колбу 1 з розчином Н2О2 зєднати із зворотним холодильником 5 і встановити проти отвору 6 і захисного щитка 7. Відкрити кран 8 і рівень рідини в бюретці 3 при допомозі зрівнювальної склянки 4 поставити на нуль. Пустити воду в холодильник і дочекати моменту, коли встановиться рівень рідини в газовій бюретці при закритому крані 8. Рівень рідини, що змінився в бюретці, встановити відкриттям крану 8. Цим досягається сталість тиску, що рівний атмосферному. Після вирівнювання рівней при закритому крані 8 включається одночасно ртутнокварцева лампа і секундомір. Перший підрахунок записати після того, коли виділяться 1,0 -1,5 см3 кисню, потім через 3 хв., коли швидкість виділення газу досягне 1 см3/хв., підрахунки вести через хвилину. При підрахунку об’єму газу 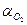 , необхідно вирівняти рівні рідин в зрівнювальній склянц і газовій бюретці.
, необхідно вирівняти рівні рідин в зрівнювальній склянц і газовій бюретці.
Дослід припинити, коли виділиться 75-100 см3 газу. Дослідні дані записати в таблицю:
| № вимірювань | Час від початку р-ції, с | Покази бюретки | Об’єм О2, що виділився,м3 | Швидкість р-ції, м/с | lgv |
При обробці експериментальних даних побудувати графік в системі координат 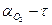 . Ця залежність необхідна для розрахунку швидкості. Швидкість у різні моменти часу визначається
. Ця залежність необхідна для розрахунку швидкості. Швидкість у різні моменти часу визначається
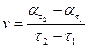 .
.
Інтервал часу  брати рівним 2 хвилини. Аналітична залежність швидкості від часу виражається рівнянням
брати рівним 2 хвилини. Аналітична залежність швидкості від часу виражається рівнянням
 , що в логарифмічній формі
, що в логарифмічній формі 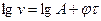 .
.
Для знаходження емпіричних констант А і φ побудувати графік залежності v і τ і по наростаючій кривій взяти значення v в різні моменти часу і накреслити графік у системі координат 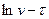 .
.
Величина φ визначається як тангенс кута нахилу одержаної прямої до осі τ, а 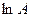 - як відрізок, що відтинається прямою на осі
- як відрізок, що відтинається прямою на осі 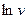 при значенні
при значенні 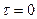 .
.
Х. ФІЗИКОХІМ ІЯ ДИСПЕРСНИХ СИСТЕМ.
1. МЕТОДИ ОДЕРЖАННЯ КОЛОЇДНИХ РОЗЧИНІВ
Колоїдним розчином або золем називається система, яка склада-
ється з частинок дисперсної фази розміром 10–9–10–7 м або 10–7–10-5 см дисперсійного середовища.
Частинки дисперсної фази можуть бути твердими (кристалічними або аморфними), рідкими і газоподібними.
На сьогодні встановлено, що будь-яку речовину можна одержати у вигляді колоїдного розчину, якщо підібрати відповідні умови досліду.
І. ПРИГОТУВАННЯ ЗОЛЮ БЕРЛІНСЬКОЇ ЛАЗУРІ
Для роботи необхідно: розчини  (концентрації 0,1 г/л та 20 г/л); 2%
(концентрації 0,1 г/л та 20 г/л); 2% 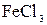 ; колби на 50 мл – 2 шт.; мірні піпетки.
; колби на 50 мл – 2 шт.; мірні піпетки.
Готують 20 мл розбавленого розчину гексаціаноферату калію 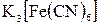 концентрації 0,1 г/л і по краплях додають 1–2 мл 2%-ного розчину хлориду заліза (ІІІ).
концентрації 0,1 г/л і по краплях додають 1–2 мл 2%-ного розчину хлориду заліза (ІІІ).
Для порівняння готують 20 мл розчину гексаціаноферату калію кон-
центрації 20 г/л і додають 10–20 мл 2%-ного розчину хлориду заліза (ІІІ).
Висновки і спостереження записують у журнал.
ІІ. ПРИГОТУВАННЯ ЗОЛЮ КАНІФОЛІ
Для роботи необхідно: 2% розчин каніфолі в етиловому спирті; дистильована вода; колба на 100–250 мл.
Готують 2%-ний розчин каніфолі в етиловому спирті. По краплях при енергійному перемішуванні (струшуванні) приливають його у великий об’єм дистильованої води (з розрахунку 5 мл спиртового розчину каніфолі на 50 мл води). Утворюється прозорий, сильно опалесціюючий ліофобний золь каніфолі у воді.
Частинки каніфолі в цьому розчині заряджені негативно.
ІІІ. ПРИГОТУВАННЯ ГІДРОЗОЛЮ СІРКИ
Для роботи необхідно: 2% розчин сірки в спирті; дистильована вода; колба на 50–100 мл.
Заздалегідь готують розчин сірки в етиловому спирті, періодично збов-
туючи сірку в спирті. Залишок сірки, яка не розчинилась, відфільтровують.
Гідрозоль сірки одержують, доливаючи по краплях 5 мл її спир-
тового розчину до 20 мл дистильованої води. Будова міцели сірки в цьому розчині невідома. Частинки сірки зарядженні негативно.
ІV. ПРИГОТУВАННЯ ЗОЛЮ ГІДРОКСИДУ ЗАЛІЗА
Для роботи необхідно: 2% розчин 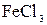 ; мірні циліндри на 30 і 200 мл; колба на 250 мл; 8 колб на 25 мл; розчин солі К2SO4; розчин солі
; мірні циліндри на 30 і 200 мл; колба на 250 мл; 8 колб на 25 мл; розчин солі К2SO4; розчин солі 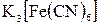 .
.
Цей метод застосовується, в основному, для одержання золів гідро-
ксидів важких металів. Суть його полягає в слідуючому: в колбі нагрі-
вають до кипіння 200 мл дистильованої води і в неї додають окремими порціями 30 мл 2%-ного розчину 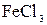 . Спочатку одержується гідрат оксиду феруму (ІІІ) по схемі (за рівнянням реакції):
. Спочатку одержується гідрат оксиду феруму (ІІІ) по схемі (за рівнянням реакції):
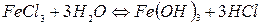
Молекули 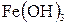 вступають у хімічну взаємодію з НСl:
вступають у хімічну взаємодію з НСl:
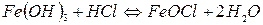
Молекули 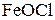 дисоціюють на йони:
дисоціюють на йони:
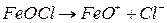
На поверхні колоїдної частинки із розчину адсорбуються ті йони, які за своєю природою близькі до складу ядра. Тоді будову колоїдної частинки золю гідроксиду феруму (ІІІ) схематично можна зобразити так:

2. КОАГУЛЯЦІЯ КОЛОЇДНИХ РОЗЧИНІВ ЕЛЕКТРОЛІТАМИ
Одержаний і охолоджений до кімнатної температури золь гідроксиду феруму (ІІІ) розливають у 8 колбочок по 20 мл в кожну.
Золь 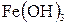 в перших двох колбочках титрують розчином К2SO4, золь інших двох колбочок – розчином
в перших двох колбочках титрують розчином К2SO4, золь інших двох колбочок – розчином 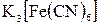 до початку коагуляції, що спостерігають до помутніння золю.
до початку коагуляції, що спостерігають до помутніння золю.
В чотири наступні колбочки наливають 0,5%-ний розчин желатини по 10 крапель і теж титрують розчинами К2SO4 і 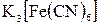 . В цьому випадку електролітів йде більше. Це вказує на те, що желатина підвищує стабільність колоїдів, виявляючи захисну дію.
. В цьому випадку електролітів йде більше. Це вказує на те, що желатина підвищує стабільність колоїдів, виявляючи захисну дію.
Результати титрування записують в таку таблицю:
| Номери колбочок | К2SO4, 10-6м3 | Номери колбочок | K3[Fe(CN)6], 10-6м3 | |
| Без желатини | ||||
| З желатиною |
3. ВИЗНАЧЕННЯ ВЕЛИЧИНИ ЕЛЕКТРОКІНЕТИЧНОГО
ПОТЕНЦІАЛУ МЕТОДОМ ЕЛЕКТРОФОРЕЗУ
Для роботи необхідно: прилад для електрофорезу; вольтметр; золь гідроксиду заліза (ІІІ); 0,001 н. розчин NaOH.
Величину електрокінетичного потенціалу можна визначити, викорис-
товуючи електрофорез – рух мікроскопічних частинок, завислих у воді, під впливом постійного струму. Це явище першим спостерігав у 1807 р. про-
фесор Московського університету Ф.Ф. Рейсс.
 Прилад для електрофорезу являє собою U-подібну скляну трубку
Прилад для електрофорезу являє собою U-подібну скляну трубку
(див. рисунок) з двома кранами 1 і 2. Знизу ця трубка з’єднана за допомогою крана 3 з трубкою 6, яка переходить у лійку. Прилад заповнюють через лійку колоїдним розчином при відкритих кранах, після чого закривають кришкою лійку, закручують всі крани і надлишок колоїдного розчину з обох колін U-подібної трубки зливають. Потім в обидва коліна наливають прозорий незафарбований електроліт (бокову рідину), електропровідність якого повинна дорівнювати електропровідності колоїдного розчину. Далі відкривають крани 1 і 2 і повільно – кран 3. При цьому колоїдний розчин піднімається вище кранів, а розчин електроліту піднімається до тих пір, поки в нього не зануряться електроди 4. Тоді кран 3 закривають. Між зафарбованим золем і електролітом повинна встановитись чітка межа (границя). Вмикають джерело постійного струму 8 і спостерігають пере-
міщення границі зафарбованого золю по шкалі 5, точно відзначаючи час початку й кінця досліду і відповідний шлях переміщення золю S.
За допомогою гнучкої дротини вимірюють відстань (середню) між електродами і обчислюють середню величину градіента потенціалу
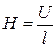 .
.
Величину U визначають за вольтметром 7.
Величину x- потенціалу обчислю-
ють за формулою:
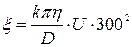 (1)
(1)
де D – діелектрична стала рідини;
h – в’язкість рідини, Н×с/м2;
k – стала, яка залежить від форми частинок;
U – електрофоретична швидкість, що дорівнює шляху (м), який про-
ходять частинки за 1 с при градієнті потенціалу Н величиною В на 0,01 м. Для золів гідроксиду заліза і берлінської блакиті величина k = 4 (для глобулярних частинок).
Величину електрофоретичної швидкості U визначають за формулою
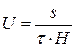 , (2)
, (2)
де S – шлях, м, який пройшли частинки за час Т, с.
Як джерело постійного струму використовують батарею гальванічних елементів напругою 60–80 В. Можна використати змінний струм, підклю-
чивши випрямляч.
Для дослідів зазделегідь готують золь гідроксиду заліза і віддіалі-
зовують його, як бокову рідину використовують розчин хлориду амонію концентрацією 1 г/л.
Заготовлений золь гідроксиду розливають у 4 посудини по 25–50 мл у кожну і додають в першу 0,001 н. розчину їдкого натру, у другу 10 мл, у третю – 5 мл.
Замість золю гідроксиду заліза можна використати будь-який забарв-
лений золь (наприклад, берлінської блакиті).
Якщо застосовують прилад тільки з одним краном (без кранів 1 і 2
U-подібної трубки), то колоїдний розчин наливають у прилад з закритим краном так, щоб тонка трубка і лійка заповнились ним. Потім наливають в U-подібну трубку 6–10 мл бокової рідини, вставляють платинові електроди так, щоб вони були на відстані 5–6×10–2 м від верхніх країв U-подібної трубки. Потім обережно трохи відкривають кран, щоб золь повільно перетікав у U-подібну трубку. При цьому повинна зберігатися чітка межа поділу між забарвленим золем і боковою рідиною. Коли бокова рідина досягне 1/2–3/4 платинових електродів, кран закривають.
Результати дослідів записують у таку таблицю:
| № розчину | Тривалість електрофорезу, с | Шлях, що пройшла границя забарвленого золю,10-3 м | Напруга, U, В |
4. ВИВЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ БІЛКІВ
Для роботи необхідно: розчини: 0,01н. СН3СООН; 0,1 н. СН3СООН; 1 н. СН3СООН; 0,1 н. СН3СООNa; розчин казеїну в 0,1 н. CH3COOONa; індикатор метилоранж; піпетка, градуйована на 10 мл; штатив з пробір-
ками.
Білки, які складають основу протоплазми, мають ряд властивостей, що витікають з їх специфічної хімічної природи.
Молекули білків являють собою довгі ланцюги типу полімерів, що складаються з багатьох амінокислот.
Спрощену схему структури білкової молекули можна представити таким чином:

Зі схеми видно, що молекула білка поряд з вуглеводневим радикалом містить значну кількість полярних гідрофільних груп: –СООН; –NH2; =СО; =NH.

 У зв’язку з цим білки мають високогідрофільні властивості. При-
У зв’язку з цим білки мають високогідрофільні властивості. При-
сутність основної групи –NH2 і кислотної –СООН зумовлюють амфотерні властивості білкової молекули, яка має основні властивості, коли пере-
важає вплив аміногрупи, і кислотні, коли переважає вплив
карбоксильної групи
У водних розчинах білки проявляють властивості слабих електролітів. В цьому випадку проходить дисоціація і основної, і кислотної групи.
В кислому середовищі дисоціація карбоксильних груп понижується водневими йонами, які присутні в надлишку. При цьому білкова молекула заряджається позитивно. Наприклад, в присутності соляної кислоти про-
ходить реакція:
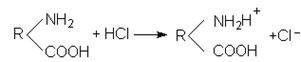
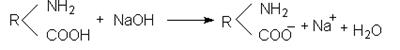
В лужному середовищі внаслідок надлишку іонів ОН– понижується дисоціація основної групи –NH2 і білкова молекула заряджається нега-
тивно.
Отже, при певній концентрації водневих йонів (тобто при певному значенні рН середовища) кількість йонізованих основних груп і сумарний заряд частинки буде рівним нулю, тобто система буде знаходитись в ізоелектричному стані. Концентрація водневих йонів, виражена величиною водневого показника рН, при якій молекула білка знаходиться в ізоелек-
тричному стані, називається ізоелектричною точкою.
Для кожного білка існує певне значення рН, при якому він знахо-
диться в ізоелектричному стані. Для більшості білків їх ізоелектрична точка лежить в кислому середовищі при рН<7.
Це пояснюється тим, що на поверхні білкової молекули переважають кислотні групи, константа дисоціації яких набагато більша від константи дисоціації основних груп. Так як в ізоелектричній точці по всій довжині молекули розташовується однакова кількість протилежно заряджених ос-
новних і кислотних груп, то внаслідок електростатичних сил притягування молекула білка скручується в клубочок, стає більш компактною, густина її збільшується. Властивості, зв’язані з формою і зарядом макромолекули, при цьому змінюються. Так, наприклад, в ізоелектричному стані в’язкість, набухання, розчинність білків зменшуються. На пониженні розчинності білків в ізоелектричному стані ґрунтується методика визначення ізоелек-
тричної точки казеїну.
При виконанні практичної частини роботи беруть штатив на 18 про-
бірок – два ряди по 9 пробірок.
Згідно нижче приведеної таблиці в усі 18 пробірок за допомогою гра-
дуйованої піпетки заливають дистильовану воду, 0,01 н.; 0,1 н.; 1 н. роз-
чини оцтової кислоти. До пробірок першого ряду доливають по 1 мл свіжо приготовленого казеїну в 0,1 н. розчині оцтовокислого натрію. До пробірок другого ряду доливають по 1 мл 0,1 н. розчину оцтовокислого натрію і індикатор метилоранж. При цьому одержуємо буферні суміші з різними значеннями рН, причому в обох рядах пробірок склад буферних сумішей однаковий.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 523; Нарушение авторских прав?; Мы поможем в написании вашей работы!