
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 2 страница
|
|
|
|
Методика експерименту
У чотири колбочки вносять по 1 г активованого вугілля і наливають із бю-
ретки по 25 мл розчинів оцтової кис-
лоти різної молярної концентрації (0,05; 0,1; 0,2; 0,4 моль/л). Колбочки пері-одично збовтують близько 20 хвилин. Потім розчини фільтрують через папе-рові фільтри в сухі колбочки, відкидаючи перші 3–5 мл фільтрату (для уникнення похибок за рахунок адсорбції кислоти на фільтрі). Рівноважну молярну концентрацію кислоти у фільтраті визначають титруванням 5 мл розчину розчином NaOH (c(NaOH) = 0,1 моль/л) у присутності фенол-
фталеїну. Кожний розчин титрують 2–3 рази. Потім за формулою (2) розраховують величину адсорбції оцтової кислоти, а також находять lg c i lg 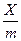 . Результати розрахунків заносять у таку таблицю:
. Результати розрахунків заносять у таку таблицю:
| со, моль/м3 | с, моль/м3 | Х/m, кмоль/кг | lgc | lgX/m | K | 1/n |
Користуючись даними таблиці, будують ізотерму адсорбції оцтової кислоти, при цьому на осі абсцис відкладають рівноважну молярну концентрацію с, а на осі ординат – значення 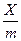 . Постійні К і
. Постійні К і 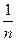 у рівнянні Фрейндліха визначають, як було вказано, з графіку залежності lg
у рівнянні Фрейндліха визначають, як було вказано, з графіку залежності lg 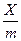 від lg c.
від lg c.
4. ДОСЛІДЖЕННЯ АДСОРБЦІЇ ЗАБАРВЛЕНИХ РЕЧОВИН ІЗ РОЗЧИНІВ
У ряд пробірок помістити по 1 мл розчину з масовою часткою 0,02% метиленової сині,  ,
, 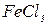 , золю
, золю 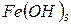 , конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-
, конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-
тягом 2–3 хв і відфільтрувати. Спостерігати зміну забарвлення та пояснити явище адсорбції.
Результати роботи занести в таблицю:
| Назва розчину | |||||||
| Забарвлення розчину до адсорбції | |||||||
| Забарвлення розчину після адсорбції | |||||||
| Висновок про характер адсорбції |
5. ДОСЛІДЖЕННЯ АДСОРБЦІЇ ІЗОАМІЛОВОГО СПИРТУ ІЗ РОЗЧИНУ ЗА ДОПОМОГОЮ АКТИВОВАНОГО ВУГІЛЛЯ
Для роботи необхідно: 0,1 моль/л розчин ізоамілового спирту; сталагмометр; штатив з пробірками; активоване вугілля.
Поверхневий натяг розчину визначити сталагмометричним мето-
дом, описаним в роботі V.1. Потім помістити 10 мл цього розчину у про-
бірку, додати 0,2 г активованого вугілля і перемішувати протягом 2–3 хв. Відфільтрувати розчин і знову визначити його поверхневий натяг. Пояс-
нити, чому він змінився.
6. ВИЗНАЧЕННЯ ПОВНОЇ ОБМІННОЇ ЄМНОСТІ (ОЄ) КАТІОНІТУ
Для роботи необхідно: 0,1 моль/л NaOH; 0,1 моль/л розчин НСl; мірна колба на 250 мл; катіоніт; індикатор.
Обмінна ємність – це кількість еквівалентів (ммоль) речовини адсор-
бованої 1 г адсорбента. У колбу об’ємом 250 мл помістити 1 г катіоніту, додати 100 мл 0,1 моль/л розчину NaOH, перемішати і залишити на
1 годину. Після цього відібрати піпеткою 25 мл розчину і перенести її в колбу для титрування. До проби додати 1–2 краплі індикатора і відтитрувати 0,1 кмоль/м3 розчином НС1 до зміни забарвлення індикатора. Обмінну ємність вираховують за формулою  .
.
7. ВИЗНАЧЕННЯ ВМІСТУ ЛІКАРСЬКОЇ РЕЧОВИНИ (ГЛЮКОНАТУ КАЛЬЦІЮ) В РОЗЧИНІ МЕТОДОМ ЙОНООБМІННОЇ АДСОРБЦІЇ
Для роботи необхідно: глюконат кальцію; Н-катіоніт; 0,1 М розчин NaOH; індикатор метиловий оранжевий.
УВАГА! При роботі з колонкою не допускається проникнення повітря в йоніт. Рівень рідини не повинен опускатися нижче верхнього рівня йоніту.
Через колонку з Н-катіонітом повільно пропускають 20 мл дослід-
жуваного розчину, який містить глюконат кальцію. Потім колонку проми-
ти 25 мл дистильованої води, збираючи її в ту ж колбу. Весь зібраний фільтрат відтитрувати 0,1 М розчином NaOH з індикатором метиловим оранжевим. Вміст глюконату кальцію вирахувати за формулою:
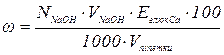 .
.
8. ОБЕЗСОЛЮВАННЯ ВОДИ ЗА ДОПОМОГОЮ ЙОНІТІВ
Для роботи необхідно: Н-катіоніт; ОН-аніоніт; оксалат амонію; нітрат аргентуму; піпетка; штатив з пробірками; метилоранж.
Для обезсолювання води взяти воду з водогону. За допомогою якісних реакцій виявити у воді йони хлору (реакцією з AgNO3) і йони кальцію (реакцією з оксалатом амонію (NH4)2C2O4).
Через колонку з Н-катіонітом пропустити повільно 25 мл води з водогону, потім промити 25 мл дистильованої води. З отриманого розчину відібрати піпеткою по декілька крапель у 2 пробірки. В 1-й перевірити наявність Са2+ (реакція з (NH4)2C2O4), в 2-й – наявність йонів Н+ (ме-
тилоранж). З одержаного попереднього розчину відібрати 25 мл і про-
пустити через колонку з ОН-аніонітом та промити 25 мл дистильованої води. Відібрати в пробірку декілька крапель розчину і перевірити наявність йонів С1–.
9. РОЗДІЛЕННЯ ЙОНІВ Fе3+, Cu2+,Co2+ МЕТОДОМ ХРОМАТОГРАФІЇ НА ОКСИДІ АЛЮМІНІЮ
Для роботи необхідно: А12О3; металевий штатив; розчини CuSO4, FeCl3 i CoCl2.
Колонку з адсорбентом (А12О3) закріпити у штатив і пропустити через неї 1 мл суміші, що складається з рівних об’ємів розчинів CuSO4, FeCl3 i CoCl2 з масовою часткою 0,1. Спостерігати забарвлення розчину. У про-
токолі замалювати шари адсорбенту відповідними кольорами.
VI. РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ
1. ВИЗНАЧЕННЯ КРИТИЧНОЇ ТЕМПЕРАТУРИ
ВЗАЄМНОГО РОЗЧИНЕННЯ РІДИН
Для роботи необхідно: прилад для визначення критичної температу-
ри; плитка електрична; технічні терези; піпетка, градуйована на 5–10 мл; штатив з пробірками; фенол; вода.
У випадку обмеження взаємної розчинності двох рідин у певній області концентрації завжди має місце рівновага між двома розчинами різного складу.
Очевидно, при заміні температури ця рівновага буде змінюватися в ту чи іншу сторону. Всі ці співвідношення можуть бути подані графічно на діаграмах температура – склад.
Температура, вище або нижче якої рідини взаємно розчинні у всіх співвідношеннях, називається критичною температурою розчинення. Роз-
різняють верхню і нижню критичні температури розчинення.
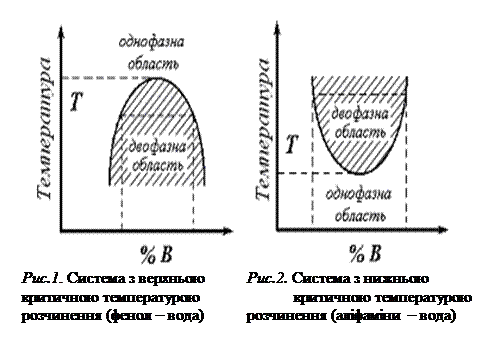 |
Нижче приводяться приклади діаграм температура – склад систем з верхньою і нижньою критичними температурами розчинення (рис. 1, 2, 3).
Криву взаємної розчинності двох рідин найпростіше знайти, визна-
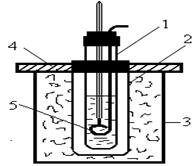
чаючи температуру зникнення або появи другої фази. Для визначення цієї температури зручно використовувати прилад, зображений на рис. 4.
Колба 1 служить водяною або масляною банею, в пробірку 2 помі-
щають досліджувану суміш, в неї на коркові вставляють термометр 3 і мішалку 4.
Виходячи з загальної наважки і процентного вмісту, розраховують ва-
гові кількості для одержання досліджуваних сумішей.
Якщо другими компонентами буде рідина, то її можна брати в об’єм-
них одиницях. Для цього необхідно знати її густину. Густина води при температурі досліду приймається рівною одиниці.
Для дослідження беруть дві речовини, що погано розчиняються одна в одній, наприклад система фенол – вода.
Готують декілька сумішей з різним процентним складом, який вка-
зується керівником занять. Загальна вага суміші не повинна перевищува-
ти 5–6 г.
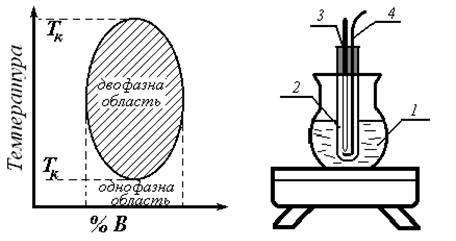
Рис. 3. Система з верхньою і Рис. 4. Схема приладу для
нижньою критичними визначення критичної
температурами розчинення температури розчинення.
(нікотин – вода).
Спочатку зважують необхідну кількість фенолу, потім відмірюють не-
обхідну кількість води для одержання суміші певного процентного складу.
Встановлюють пробірку в прилад для визначення критичної темпера-
тури і відмічають дві температурні точки: температуру гомогенізації (пере-
хід системи в одну фазу) і температуру гетерогенізації (розділення системи на дві фази).
Для одержання точних даних потрібно змінювати температуру повіль-
но, при безперервному перемішуванні суміші в пробірці з метою уник-
нення перегріву, переохолодження.
При роботі з фенолом потрібно слідкувати за тим, щоб він не потра-
пив на шкіру, так як він викликає опіки.
По одержаних даних будують діаграму: температура – склад, по якій визначають критичну температуру розчинення і проводять контрольне визначення процентного складу по температурі взаємного розчинення. Результати дослідів заносять у таблицю:
| №№ пробірок | ||||||||||||
| % фенолу | ||||||||||||
| Наважка фенолу, кг | ||||||||||||
| Наважка води, кг | ||||||||||||
| Температура гомогенізації, К | ||||||||||||
| Температура гетерогенізації, К | ||||||||||||
| Середня температура, К |
2. ВИЗНАЧЕННЯ МОЛЕКУЛЯРНОЇ МАСИ РОЗЧИНЕНОЇ
РЕЧОВИНИ КРІОСКОПІЧНИМ МЕТОДОМ
Для роботи необхідно: кріоскоп; пробірка для розчину з мішалкою; термометр Бекмана; стаканчик фарфоровий; лід; сіль; речовина і розчини для дослідження.
Виходячи з сучасної теорії розведених розчинів, встановлена залеж-
ність пониження точки замерзання  розчинника від концентрації роз-
розчинника від концентрації роз-
чиненої в ньому речовини:
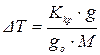 ,
,
де Ккр – кріоскопічна стала; g – вага розчиненої речовини, кг; gо – вага розчинника, кг; М – молекулярна маса розчиненої речовини. Це рівняння справедливе для розведених розчинів, що не дисоціюють на йони, а також неасоційованих.
Розв’язавши це рівняння відносно молекулярної маси М, експери-
ментально визначаючи величини, що входять до нього, можна розрахувати молекулярну вагу неелектроліту:
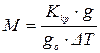 ,
,
де gо – вага розчинника, кг (її можна брати і в об’ємних одиницях, знаючи густину розчинника). Для води густина приблизно дорівнює 1.
Визначаючи експериментально пониження температури замерзання розчину неелектроліту, можна розрахувати його молярність, виходячи з того, що кріоскопічна стала Ккр – молярне пониження точки замерзання розчинника, тобто таке пониження температури, яке спостерігається, коли в 1 кг розчинника розчинений 1 моль речовини.
Молярну концентрацію розчину неелектроліту визначають за фор-
мулою:
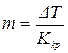 .
.
Значення кріоскопічної сталої залежить від властивостей і виража-
ється рівнянням:
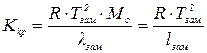 ,
,
де R – газова стала в калоріях; T – абсолютна температура замерзання розчинника; Mo – молекулярна маса розчинника; lзам. – молекулярна теплота замерзання розчинника; lзам. – питома теплота замерзання роз-
чинника.
Температури замерзання деяких розчинників, а також кріоскопічні сталі приведені в табл. 2, що знаходиться в кінці опису.
У випадку слабких електролітів число молекул і йонів у і разів більше числа початково взятих молекул:
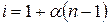 ,
,
де і – коефіцієнт Вант-Гоффа; a – ступінь дисоціації; п – число йонів, які утворюються з однієї молекули. Тому рівняння для пониження темпе-
ратури замерзання у випадку слабких електролітів можна записати в такому вигляді:
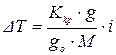 .
.
Для електролітів, молекулярна маса яких невідома, розв’язуючи це рівняння, одержимо:
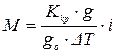 .
.
У випадку слабких електролітів, при відомій молекулярній масі, можна підрахувати коефіцієнт Вант-Гоффа:
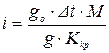 .
.
Знаючи і, підраховують ступінь дисоціації електролітів
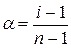 .
.
| Рис.1 |
Прилад для кріоскопічних вимірювань, зображений на рис. 1, складається з таких частин. Пробірка 1 закріплена на коркові в металевому посуді 2, який відіграє роль повітряної сорочки. Стакан 3, в який помі-
щають охолоджуючу суміш, закривається криш-кою 4 з двома отворами, в один з яких вставляють корок для пробірки 1, а в другий – мішалку 5.
Перш ніж приступити до роботи, необ-
хідно ознайомитися з термометром Бекмана (рис. 2.).
 Рис. 2.
Рис. 2.
|
Особливістю цього термометра є велика довжина шкали (приблизно
5 см на 1 К) і наявність у верхній частині термометра запасного резервуара з ртуттю, який дає можливість змінювати кількість ртуті в робочій частині термометра. Велика довжина шкали дозволяє робити від-
ліки з необхідною для вимірів точністю, а запасний резервуар дає можливість встанов-
лювати термометр на різні температурні інтервали.
Шкала термометра розділена на 5 К, кожний градус ділиться на десяті долі, а кожна десята доля в свою чергу ділиться на соті долі; тисячні долі можуть бути при-
близно розраховані за допомогою лупи.
Термометр для кріоскопічних вимірів налагоджується так, щоб при температурі замерзання рівень ртуті знаходився між третім і п’ятим градусами. Перед наладкою термометра перевіряють його покази при умовах, необхідних для роботи. Якщо рівень ртуті в капілярі не буде встановлюватися між 3 К і 5 К, термометр необхідно налагодити. Це робиться наступним чином: затискують рукою нижній резервуар ртуті, тобто нагрівають його і з’єднують із стовпчиком ртуті в верхньому резервуарі. Якщо в нижньому резервуарі був надлишок ртуті, тобто ртуть піднімалась у попередньому досліді вище п’ятого градусу, то після з’єднання обох резервуарів необхідно частину ртуті перевести в верхній резервуар. Для цього термометр повертають верхнім резервуаром вниз. Якщо ртуть у попередньому досліді опускалась нижче нуля, тобто в нижньому резервуарі ртуті недостатньо, то частину ртуті необхідно перелити з верхнього в нижній резервуар.
Для цього з’єднують верхній і нижній резервуар, і нижній резервуар охолоджують в суміші льоду і води. Після того, як ртуть перейде в деякій кількості в потрібному напрямку, розривають стовпчик ртуті в капілярі. Нижній резервуар затискають у долоні і легким постукуванням однієї руки по другій розривають стовпчик ртуті. У випадку, коли ртуть не зупи-
няється в потрібному інтервалі температур, налагодження повторюють.
Налагоджений термометр залишають у стакані з льодом і присту-
пають до наступної операції.
Розчинник наливають у пробірку в такій кількості, щоб після зану-
рення в нього термометра Бекмана рівень рідини був на 2–3 см вищий верх-
ньої частини нижнього резервуару, а нижня частина резервуару не повин-на доходити до дна на 1–2 см. У більшості випадків заливають 25–40 мл розчинника.
Потім готують охолоджену суміш із води, льоду і солі з температурою на 3–4 К нижче температури замерзання розчинника. Заповнюють охо-
лоджуючою сумішшю стакан 3, проводять наближене визначення to замерзання розчинника. Для цього пробірку з розчинником і вставленим в неї термометром поміщають безпосередньо в охолоджуючу суміш. Перемішуючи рідину, спостерігають за показами термометра. Внаслідок переохолодження температура опускається нижче точки замерзання; коли починається кристалізація в результаті виділення теплоти кристалізації, температура розчину починає підвищуватися. По термометру відра-
ховують максимальну температуру, яка й приймається за наближену температуру замерзання. Наближеною вона являється тому, що дослід проводиться в умовах, які не виключають нерівномірностей охолодження.
Після наближеного визначення температури пробірку виймають з охолоджуючої суміші і розплавляють утворені кристали, опускаючи про-
бірку у воду кімнатної температури. Потім ставлять пробірку у повітряну сорочку 2 приладу. Для прискорення процесу охолодження рідину в пробірці 1 перемішують мішалкою 5. Коли встановиться температура приблизно на 0,5 К вище попередньо знайденої наближеної температури кристалізації, перемішування припиняють і переохолоджують рідину на 0,2–0,5 К нижче наближеної температури. Перемішуючи переохолоджений розчинник, зумовлюють його кристалізацію. Процес кристалізації супро-
воджується виділенням прихованої теплоти плавлення, яка, в свою чергу, веде до збільшення температури. Максимальну температуру, яка спосте-
рігалась при кристалізації, відмічають, користуючись лупою з точністю до 0,002 К і записують як температуру замерзання розчинника.
Вимірювання температури замерзання чистого розчинника повто-
рюють декілька разів. Після кожного визначення пробірку 1 виймають з приладу, утворені кристали розплавляють, як було вказано вище.
Середнє арифметичне з окремих вимірів приймають за дійсне зна-
чення температури замерзання розчинника. Графічна похибка не повинна перевищувати 0,005 К.
Для визначення молекулярної маси досліджуваної речовини беруть наважку g 0,2–0,3 г з точністю зважування до 0,0001 г і розчиняють її в даному розчиннику.
Наближену температуру кристалізації визначають так, як і для роз-
чинника.
Визначення проводять 3 рази. Середнє значення трьох вимірів беруть за дійсне.
В даній роботі студент повинен виконати наступні завдання:
1. Визначити молекулярну масу речовини.
2. Визначити ступінь дисоціації слабкого електроліту або коефіцієнт активності сильного електроліту.
3. Визначити молярну концентрацію розчину неелектроліту.
Результати роботи і розрахункові дані записують по формі:
Об’єм розчинника V =
Вага розчинника go =
Вага розчиненої речовини g =
Електроліт для визначення ступені дисоціації
Об’єм, взятий для досліджування молярної концентрації Vk =
Вага розчинника go =
Вага розчиненої речовини g =
Досліджувані і розрахункові дані заносяться в табл. 1.
Таблиця 1
| Температура кристалізації, К | Середня температура кристалізації, К | Пониження температури кристалізації, К | Результати | |
| Чистий розчинник | ||||
| Розчин для ви- значення моле- кулярної маси | ||||
| Розчин для ви- значення молекулярної концентрації | ||||
| Розчин для ви- значення ступені дисоціації |
Таблиця 2
| Розчинник | Тзам., К | Обрахована Ккр | Експери- ментально визначена Ккр |
| Вода | 273,2 | 1,862 | 1,86 |
| Нітробензол | 278,8 | 6,83 | 6,90 |
| Бензен | 278,9 | 5,12 | 5,10 |
| Фенол | 313,2 | 7,80 | 7,80 |
| Камфора | 451,2 | 48,20 | 49,00 |
VII. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
1. ВИЗНАЧЕННЯ ЕЛЕКТРОПРОВІДНОСТІ ЕЛЕКТРОЛІТІВ І ОБЧИСЛЕННЯ СТУПЕНЯ ДИСОЦІАЦІЇ
Для роботи необхідно: реохорд АВС; звуковий генератор ЗГ; на-
вушники Т або осцилограф; посуд для визначення електропровідності і платинові електроди Б; мірна колба на 50–100 мл; піпетки мірні; колбочки мірні; розчини електролітів; магазин опору.
Так як електропровідність є величиною обернено пропорційною опо-
рові, то визначення її зводиться до вимірювання опору. Електрична схема, за якою проводиться вимірювання опору, подана на рис. 1.
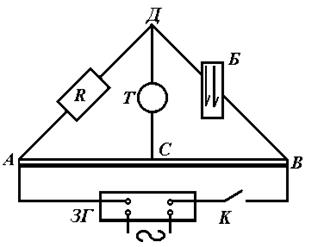
Рис. 1. Електрична схема для визначення
електропровідності (мостик Кольрауша).
Від джерела струм поступає в А, розгалужується, іде по АВС і АДС. Переміщаючи контакт С по дротині АВ, можна знайти таке положення, при якому на відрізку ДС струму не буде. Це має місце, коли
 ,
,
звідки
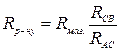 .
.
При визначенні електропровідності користуються слабкими стру-
мами високої частоти. Як джерело струму використовують звуковий генератор; як нуль-інструмент використовують навушники або осци-лограф. Точка рівноваги визначається таким положенням контакту С, при якому в навушниках зовсім не чути звуку, або він є мінімальним, або на екрані осцилографу чітка яскрава точка.
 Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-
Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-
дина з опущеними в неї трубками А і В.
До нижніх кінців трубок впаяні плати-
нові електроди С і D. Щоб запобігти поля-
ризації, поряд із застосуванням слабких змін-
них струмів високої частоти збільшують по-
верхню електродів. З цією метою електроди платинуються.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!