
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 2 страница
|
|
|
|
Схема установки для компенсаційного методу подана на рисунку. Акумулятор АК замкнутий через дротину АВ, що натягується вздовж шкали реохорду довжиною 1 м. Дротина на всій довжині реохорда однорідна і має однаковий переріз, тому спад напруги на одиницю довжини теж однаковий і рівний 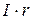 , а спад напруги на всій довжині реохорда рівний:
, а спад напруги на всій довжині реохорда рівний:
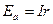 , ,
| (1) |
де І – сила струму;
r – опір одиниці довжини дротини (питомий опір).
Якщо в коло назустріч акумуляторові ввімкнули елемент з невідомою ЕРС, то, переміщуючи повзунок С по лінійці АВ, можна знайти таке положення, при якому стрілка гальванометра Г стає на нуль.
Це відбувається внаслідок того, що ЕРС гальванічного елемента Ех точно компенсується різницею потенціалів у межах між точками А і В. Якщо ця різниця потенціалів більша від ЕРС елемента, то стрілка галь-
ванометра відхиляється в одну сторону. Якщо ЕРС гальванічного елемента більша за різницю потенціалів на лінійці, то спостерігається відхилення стрілки гальванометра в протилежну сторону.
Необхідно знати ці два положення, потім зменшувати інтервал між ними до того часу, поки стрілка гальванометра прийме нульове положення.
Якщо гальванометр знаходиться в нульовому положенні, а повзунок на віддалі ах, тоді
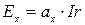 , а
, а 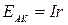 .
.
Із співвідношення
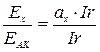 ,
,
знаходимо
 . .
| (2) |
Але ЕРС акумулятора невідома і тим більше в процесі роботи вона може змінюватись. Тому перш ніж компенсувати Ех, в електричне коло замість досліджуваного елементу включають нормальний елемент Вестона ЕN, ЕРС якого відома.
При компенсації ЕN і ЕРС акумулятора одержуємо певне положення контакта аN, тоді
 . .
| (3) |
Із співвідношення
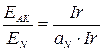 , ,
|
знаходимо
 . .
| (4) |
Підставивши рівняння (4) у рівняння (2), знаходимо Ех ЕРС дослід-
жуваного елементу:
 . .
| (5) |
Експериментальна частина роботи виконується у наступному по-
рядку.
По наведеній схемі компенсують спочатку нормальний елемент Вес-
тона, потім мідно-цинковий елемент і тільки після цього каломельно-цинковий. З одержаних даних по формулі (5) розраховують ЕРС дослід-
жуваних елементів.
Із значення ЕРС каломельно-цинкового елементу розраховують по-
тенціал цинкового електроду. Потенціал каломельного електроду по від-
ношенню до цинкового буде позитивним. Значення його в залежності від температури подані на с. 51.
Величину потенціалу цинкового електроду обраховують, виходячи із співвідношення:
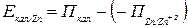 , звідси , звідси 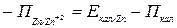 . .
| (6) |
Результати досліду і розрахункові дані записуються в таблицю:
| Елемент | Покази на лінійці | ЕРС | Електродний потенціал |
| Норм. елемент Вестона | |||
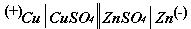
| |||
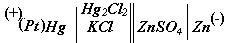
| - ПZn/Zn2+ |
2. ВИЗНАЧЕННЯ ВОДНЕВОГО ПОКАЗНИКA ПОТЕНЦІОМЕТРИЧНИМ МЕТОДОМ
Для роботи необхідно: потенціометр; акумулятор; нормальний еле-
мент Вестона; хінгідронно-каломельний елемент; гальванометр; провідни-
ки; хінгідрон; досліджувані розчини.
Для визначення рН за допомогою хінгідронного електроду користу-
ються хінгідронно-каломельним ланцюгом:
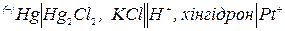
Вимірюють еРС цього ланцюга за допомогою потенціометра. рН розчину розраховують, виходячи з рівняння залежності потенціалу хін-
гідронного електроду від концентрації водневих іонів:
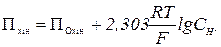 ,
, 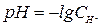
або
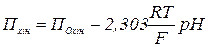 .
.
ЕРС хінгідронно-каломельного елементу набуває вигляду:
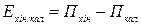 .
.
Підставляючи в це рівняння значення Пхін і Пкал, одержуємо:
 .
.
Звідки дістаємо розрахункову формулу:
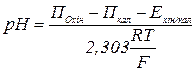 .
.
Значення нормального потенціалу хінгідронного електроду – ПОхін, потенціалу насиченого каломельного електроду – Пкал в залежності від температури, а також значення коефіцієнту 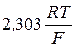 беруть з таблиць, які знаходяться у кінці опису.
беруть з таблиць, які знаходяться у кінці опису.
Для визначення еРС хінгідронно-каломельного елементу до відпо-
відних клем на потенціометрі приєднують: хінгідронно-каломельний еле-
мент, нормальний елемент Вестона, гальванометр і джерело струму. Не-
обхідно пам’ятати, що джерело струму при збиранні електричної схеми підключається останнім. Хінгідронний електрод готують таким чином.
У скляний посуд заливають досліджуваний розчин; туди ж додають хінгідрон до насичення.
 |
Розчин старанно перемішують і опускають платиновий електрод. Приготовлений хінгідронний електрод з’єднують за допомогою солевих містків з каломельним.
Компенсаційна схема потенціометра.
Готовий хінгідронно-каломельний елемент приєднують до приладу, зображеному на рисунку.
Якщо вимірювання проводяться з хінгідронним електродом, то кало-
мельний електрод приєднується до клеми “мінус”, а з водневим – до “плюс”. Перед вимірюванням ЕРС хінгідронно-каломельного ланцюга спо-
чатку проводять наладку потенціометра по нормальному елементу. Для цього ручка вмикача ставиться в положення “НЗ”, а реостатами, вмонто-
ваними в лівій частині приладу, підбирають опір, починаючи з грубої наводки і кінчаючи більш плавною до тих пір, поки стрілка гальванометра покаже відсутність струму. Потім починають визначення ЕРС дослід-
жуваного елементу. Для цього ручку вмикача ставлять в положення “Х” і реостатами, вмонтованими в правій частині приладу (починаючи з ручки 0,1 і закінчуючи 0,001 В), підбирають такий опір, при якому стрілка галь-
ванометра покаже відсутність струму, тобто стане на нуль.
Cумарне значення показів кожного реостату відповідає значенню ЕРС хінгідронно-каломельного елемента. Маючи значення ЕРС хінгідронно-каломельного електрода, по розрахунковій формулі вираховують величину водневого показника.
Результати досліду записують у табл. 1.
Таблиця 1
| Дослід. р-н | Покази потенціо-метра, В | ПОхін, В | Пкал, В | 
| рН |
Значення потенціалу насиченого каломельного електроду при різних температурах наведені в табл. 2.
Таблиця 2
| Темпера- тура, К | Потен-ціал, В | Темпера- тура, К | Потен-ціал, В | Темпера-тура, К | Потен-ціал, В |
| 0,32 | 0,2517 | 0,2425 | |||
| 0,2525 | 0,2509 | 0,2488 | |||
| 0,2517 | 0,2503 | 0,2458 |
Значення потенціалу нормального хінгідронного електроду при температурі від 281 до 301 К наведені в табл. 3.
Таблиця 3
| Температура, К | ПОхін, В | Температура, К | ПОхін, В |
| 0,6866 | 0,6948 | ||
| 0,6874 | 0,6955 | ||
| 0,6888 | 0,6970 | ||
| 0,6896 | 0,6977 | ||
| 0,6903 | 0,6985 | ||
| 0,5911 | 0,6992 | ||
| 0,6918 | 0,6999 | ||
| 0,6925 | 0,7007 | ||
| 0,6933 | 0,7011 | ||
| 0,6940 | 0,7022 |
Значення 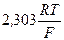 для різних температур наведені в табл. 4.
для різних температур наведені в табл. 4.
Таблиця 4
| Т, К | 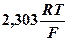
| Т, К | 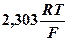
|
| 0,0561 | 0,0583 | ||
| 0,0563 | 0,0585 | ||
| 0,0565 | 0,0587 | ||
| 0,0567 | 0,0589 | ||
| 0,0569 | 0,0591 | ||
| 0,0571 | 0,0593 | ||
| 0,0573 | 0,0595 | ||
| 0,0575 | 0,0597 | ||
| 0,0577 | 0,0599 | ||
| 0,0579 | 0,0601 | ||
| 0,0581 | – | – |
3. ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ рН, РОЗРАХУНОК
КОНСТАНТИ ДИСОЦІАЦІЇ СЛАБКОЇ КИСЛОТИ
Потенціометричний метод визначення рН розчину слабкої кислоти дає можливість розрахувати константу дисоціації. Якщо для досліду взяти слабку кислоту 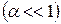 , то відомий математичний вираз закону розведення Оствальда:
, то відомий математичний вираз закону розведення Оствальда:
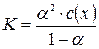
можна замінити рівністю: 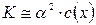 ,
,
де К – константа дисоціації кислоти;
a – ступінь дисоціації;
с(х) – молярна концентрація кислоти.
Молярна концентрація йонів водню в розчині слабкої кислоти зв’я-
зана з ступінню дисоціації і константою дисоціації відношенням:
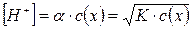 .
.
Логарифмуючи рівність 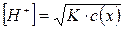 , одержуємо
, одержуємо
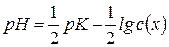 .
.
Звідси 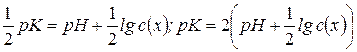 .
.
Виконання роботи полягає у визначенні рН розчину слабкої кислоти з відомою молярною концентрацією. Для вимірювань рекомендується брати розчини з молярною концентрацією від 0,01 моль/л до 0,5 моль/л.
У хімічний стаканчик об’ємом 50 мл наливають 20–30 мл дослід-
жуваного розчину слабкої кислоти. У розчин обережно занурюють елек-
троди, щоб кулька скляного електроду повністю знаходилася у розчині. Вимірюють рН розчину за допомогою рН-метра і розраховують рК за формулою 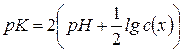 .
.
Потім за допомогою таблиці антилогарифмів визначають константу дисоціації. Порівняти одержану величину з табличною. Визначити абсо-лютну і відносну похибку.
ІХ. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
1. ВИЗНАЧЕННЯ ШВИДКОСТІ РОЗКЛАДУ
ТІОСУЛЬФАТНОЇ КИСЛОТИ
Для роботи необхідно: 0,1 моль/л розчин 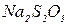 ; 1 моль/л
; 1 моль/л 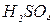 ; штатив з пробірками; бюретка; секундомір.
; штатив з пробірками; бюретка; секундомір.
Тіосульфатна кислота утворюється при взаємодії тіосульфату натрію з сульфатною кислотою:

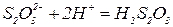
Реакція протікає дуже швидко. Розклад тіосульфатної кислоти проходить відносно повільніше:
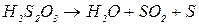
Дослід 1. Залежність швидкості розкладу тіосульфатної кислоти від її молярної концентрації
У три пробірки наливають із бюреток розчин 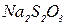 з молярною концентрацією с1
з молярною концентрацією с1 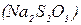 = 0,1 моль/л і дистильовану воду в об’ємах, що вказані в табл. 1. У другі три пробірки наливають із бюреток по 0,005 л розчину
= 0,1 моль/л і дистильовану воду в об’ємах, що вказані в табл. 1. У другі три пробірки наливають із бюреток по 0,005 л розчину 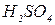 (с(
(с( 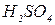 )= 1моль/л). Зливають попарно приготовлені розчини
)= 1моль/л). Зливають попарно приготовлені розчини 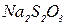 і
і 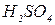 , перемішують і відмічають за секундоміром час (t) від моменту зливу розчинів до помутніння у результаті появи осаду сірки.
, перемішують і відмічають за секундоміром час (t) від моменту зливу розчинів до помутніння у результаті появи осаду сірки.
Молярну концентрацію тіосульфату натрію с2(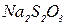 ) і початкову молярну концентрацію тіосірчастої кислоти с(
) і початкову молярну концентрацію тіосірчастої кислоти с( 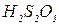 ) у приготовлених сумішах розраховують за формулою:
) у приготовлених сумішах розраховують за формулою:
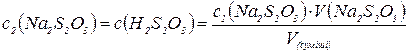 ,
,
де V(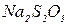 ) – об’єм розчину тіосульфату натрію, який додали, л;
) – об’єм розчину тіосульфату натрію, який додали, л;
V(суміші) – об’єм суміші, що досліджується, л.
Таблиця 1
| № досліду | Об’єми розчинів, 10-3м3 | с(H2S2O3) у суміші, що досліджується, кмоль/м3 | t, с | ||
| Na2S2O3 | Н2О | H2SO4 | |||
| 1. | 0,001 | 0,004 | 0,005 | 0,01 | |
| 2. | 0,003 | 0,002 | 0,005 | 0,03 | |
| 3. | 0,005 | 0,000 | 0,005 | 0,05 |
Роблять висновки про вплив молярної концентрації тіосірчастої кислоти на швидкість протікання реакції, порівнюючи час від моменту зливання розчинів до помутніння у результаті появи осаду сірки.
Дослід 2. Залежність швидкості розкладу тіосульфатної кислоти
від температури
У три пробірки наливають по 0,005 л розчину з молярною кон-
центрацією с(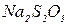 ) =0,1 моль/л, у три інші – по 0,005 л розчину
) =0,1 моль/л, у три інші – по 0,005 л розчину 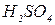 з с(
з с( 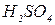 ) = 1моль/л. Поміщають усі пробірки у стакан з водою і через
) = 1моль/л. Поміщають усі пробірки у стакан з водою і через
5 хвилин, вимірявши температуру води у стакані, зливають вміст однієї пари пробірок з розчинами 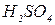 і
і 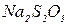 , відмічають час t від моменту злива розчинів до помутніння у результаті появи осаду сірки. Потім приливають у стакан трохи гарячої води, щоб температура збільшилась приблизно на 10 К. Витримують розчини при цій температурі 5 хвилин і зливають вміст другої пари пробірок із розчинами:
, відмічають час t від моменту злива розчинів до помутніння у результаті появи осаду сірки. Потім приливають у стакан трохи гарячої води, щоб температура збільшилась приблизно на 10 К. Витримують розчини при цій температурі 5 хвилин і зливають вміст другої пари пробірок із розчинами: 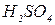 і
і 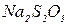 , відмічаючи час від моменту зливу розчинів до помутніння у результаті появи осаду сірки. Дослід з останньою парою пробірок проводять при температурі приблизно на 20 К вище початкової. Результати заносять у табл. 2.
, відмічаючи час від моменту зливу розчинів до помутніння у результаті появи осаду сірки. Дослід з останньою парою пробірок проводять при температурі приблизно на 20 К вище початкової. Результати заносять у табл. 2.
Таблиця 2
| № дослідів | Температура, К | t, с |
| 1. | ||
| 2. | ||
| 3. |
Роблять висновок про вплив температури на швидкість хімічної реак-
ції, будуючи графік залежності  .
.
2. КАТАЛІТИЧНИЙ ВПЛИВ ЙОНІВ ФЕРУМУ НА ШВИДКІСТЬ ОКИСЛЕННЯ ЙОДИСТОВОДНЕВОЇ КИСЛОТИ ПЕРСУЛЬФАТОМ АМОНІЮ
Для роботи необхідно: 0,5 моль/л розчини КІ, Н2SO4, СuSO4, FeSO4, (NH4)2S2O8; термостат; холодильник; дистильована вода; розчин крохмалю; конічні колби на 250 мл, піпетка.
Реакція окислення йодистоводневої кислоти персульфатом амонію можна описати рівнянням:
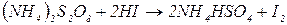 .
.
Ця реакція відбувається повільно. При наявності каталізатора – йонів міді і заліза – ця реакція істотно прискорюється.
У роботі експериментально визначають вплив йонів заліза і міді на швидкість окислення.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 406; Нарушение авторских прав?; Мы поможем в написании вашей работы!