
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Результати титрування 2 страница
|
|
|
|
Розчинність казеїну залежить від рН середовища і в ізоелектричному стані вона найменша. Це спостерігається в найбільшому помутнінні розчину. Отже, значення рН в пробірці, де помутніння розчину казеїну найбільше, відповідає ізоелектричній точці казеїну.
Очевидно, перехід забарвлення метилоранжу від оранжевого до чер-
воного в пробірках другого ряду повинен співпадати з пробіркою най-
більшого помутніння в першому ряді.
| Номер пробірок | |||||||||
| Дистильована вода, 10-6м3 | 8,3 | 7,8 | 8,7 | 8,5 | 8,0 | 7,0 | 5,0 | 1,0 | 7,4 |
| 0,01 н. СН3СООН, 10-6м3 | 0,7 | 1,2 | – | – | – | – | – | – | – |
| 0,1 н. СН3СООН, 10-6м3 | – | – | 0,3 | 0,5 | 1,0 | 2,0 | 4,0 | 8,0 | – |
| 1 н. СН3СООН, 10-6м3 | – | – | – | – | – | – | – | – | 1,6 |
| Величина рН | 5,2 | 5,6 | 5,3 | 5,0 | 4,7 | 4,4 | 4,1 | 3,8 | 3,5 |
Другий ряд пробірок являється контрольним. Перехід забарвлення індикатора від основного до кислого середовища повинен лежати в межах ізоелектричної точки казеїну. Для метилоранжу цей перехід лежить в межах рН = 2,7 – 4,7.
Через 5 – 10 хв. в ряді пробірок, які містять казеїн, зазначають ступінь помутніння. Відсутність помутніння позначають знаком “–”, його наяв-
ність – знаком “+”. Ступінь помутніння позначають різною кількістю знаків плюс або мінус (до трьох). В другому ряді пробірок відзначають забарвлення метилоранжу – “о”; перехід забарвлення – “п”; червоне –“ч”.
Результати роботи перевіряються керівником занять. Значення рН, що відповідає ізоелектричній точці казеїну записують.
5. НАБУХАННЯ ГЕЛІВ
Для роботи необхідно: желатин; 0,1 н. розчин СН3СООН; 0,1 н. роз-
чин СН3СООNa; штатив з пробірками; піпетка, градуйована на 10 мл.
Поглинання рідини студнем або гелем, що супроводжується значним збільшенням його об’єму, називається набуханням.
Процес набухання є характерною властивістю гелів у таких високомо-
лекулярних сполук, як желатина, агар-агар, каучук, що називаються елас-
тичними гелями, на противагу ненабухаючим – нееластичним гелям, до яких належать, головним чином, неорганічні гелі типу SiO2, SnO2, TiO2. Подібні гелі можуть вбирати змочуючу їх рідину. Проте їх об’єм при цьому не змінюється.
Характерною рисою високомолекулярних сполук являється асиметрія форми ниткоподібних макромолекул, що мають великі розміри ланцюгів.
Властивість еластичного гелю зв’язана з пружністю ланцюгів макро-
молекул, з яких складається основа гелю. Пружність макромолекул зале-
жить від природи атомів, що входять до складу макромолекул, від харак-
теру розподілу цих атомів, від довжини ланцюга, величини міжмоле-
кулярних сил та від температури.
Процес набухання можна уявити як проникнення молекул низькомо-
лекулярного розчинника в простір між молекулами високомолекулярної сполуки. Коли вільний простір заповнюється рідиною, молекули розчин-
ника починають розширяти ланки ланцюга полімеру, утворюючи нові пус-
тоти, які знову заповнюються низькомолекулярною рідиною. У цьому ви-
падку, коли набухлий гель далі самовільно переходить в розчин при тій же температурі, проходить необмежене набухання.
Так натуральний каучук у воді набухає, а потім переходить в розчин, утворюючи розчин високомолекулярної сполуки. У даному випадку прохо-
дить розширення ланцюгів полімеру.
Гелі желатини і агар-агару при звичайній температурі набухають у воді до певної межі і в розчин не переходять. Розширення ланцюгів прохо-
дить тільки на деяких ділянках, остання частина ланцюга залишається зв’язаною між собою. У цьому випадку проходить обмежене набухання при даній температурі. Підвищення температури приводить часто до того, що обмежено набухаючі студні починають розчинятися, як це спосте-
рігається у випадку желатини. Однак, не завжди підвищення температури приводить до розчинення, наприклад, не наступає розчинення вулкані-
зованого каучука. Це пояснюється наявністю між молекулами “мостикових зв’язків”, що затруднюють перехід макромолекул в розчин. При наявності великої кількісті таких “мостикових зв’язків”, наприклад ебоніту, прос-
торова сітка полімеру стає твердою, ланцюги втрачають свою пружність і полімер втрачає свою здатність до набухання.
Початкова стадія набухання характеризується значним виділенням тепла – теплотою набухання і тиском набухання. Сума об’ємів сухого гелю і поглиненої ним рідини більша, ніж об’єм набухлого гелю. Це явище носить назву контракції. Воно спостерігається, головним чином, у гелів, що набухають у воді (желатина, агар-агар, крохмаль) і пояснюється відносно більшою густиною орієнтованих молекул зв’язаної води. Набухання в органічних розчинниках проходить без помітної контракції.
Кількість рідини, що поглинається одним грамом гелю, називається ступенем набухання.
При необмеженому набуханні кількість рідини, що поглинається, може бути дуже великою і перевищувати десятикратний об’єм взятого для набухання гелю. Процес набухання проходить з певною швидкістю, зале-
жить від природи набухаючого геля і розчинника. Набухання проходить як реакція першого порядку.
Велику групу, що мають ряд особливостей при набуханні, пред-
ставляють гелі білкових речовин у воді і водних розчинах. В цих умовах при вимірюванні ступеня набухання необхідно врахувати рН середовища.
При певній концентрації водневих йонів від макромолекули білка від-
щеплюються йони, що відповідають як кислотній, так і основній дисо-
ціації. Лише при певному значенні рН наступає такий стан, який харак-
теризується наявністю рівної кількості позитивних і негативних зарядів; білок стає електронейтральним. Такий стан називається ізоелектричним, а рН розчину, при якому цей стан наступає – ізоелектричною точкою.
Крива залежності ступеня набухання від рН має мінімум в ізо-
електричній точці. Причина впливу водневих і гідроксольних йонів на ступінь набухання полягає в тому, що в ізоелектричному стані частинки макромолекул з’єднуються в більш складні і великі комплекси. Цей процес зумовлюється деякою десольватацією ланцюгів полімерів в ізоелектрич-
ному стані.
Хід виконання роботи
Для виконання роботи в пробірках готують 6 буферних розчинів (див. табл. 1):
В градуйовані пробірки насипають по 0,1×10–3кг сухого порошку желатини, точно відзначають об’єм сухої речовини в пробірках. Потім в кожну з пробірок вливають 5 мл одного з приготовлених розчинів з відповідним значенням рН. Через годину замірюють об’єм набухлої желатини. Ступінь набухання розраховують за формулою:
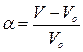 .
.
Таблиця 1
| Склад розчинів | Номери пробірок | |||||
| 0,1 н. СН3СООН, 10-6м3 | – | |||||
| 0,1 н. СН3СООNa, 10-6м3 | – | |||||
| Н2О дист., 10-6м3 | – | – | – | – | – | |
| Значення рН | 3,8 | 4,4 | 4,7 | 5,0 | 5,6 |
Дані експерименту записують у табл. 2.
Таблиця 2
| Склад розчину | Номери пробірок | |||||
| рН буферного р-ну | 3,8 | 4,4 | 4,7 | 5,0 | 5,6 | 7,0 |
| Об’єм желатини до набухання, Vo, 10-6м3 | ||||||
| Об’єм набухлої желатини, V, 10-6м3 | ||||||
| Ступінь набухання, W,% |
ХІ. БІОГЕННІ ЕЛЕМЕНТИ
s-Елементи та їх сполуки
З s-елементів до біометалів відносяться натрій, калій, магній та каль-
цій. Їх йони входять у склад буферних систем організму, забезпечують необхідний осмотичний тиск, беруть участь в утворенні мембранних по-
тенціалів, у передачі нервових імпульсів (Na+, K+), структуроутворенні (Мg2+, Ca2+). Такі s-елементи, як берилій, барій, мають дуже токсичні властивості. Знання фізико-хімічних основ s-елементів та їх сполук має важливе значення в діагностиці, профілактиці та лікуванні хвороб, виз-
ваних надлишком або недостачею s-елементів в організмі.
1. АНАЛІТИЧНІ РЕАКЦІЇ НА ЙОНИ s-ЕЛЕМЕНТІВ
Визначення йона Na+ по кольору полум’я
Очищену промиванням у концентрованому розчині соляної кислоти і прокалюванням на безкольоровому вогні горілки платинову (або ніхро-
мову) проволоку обмокують у розчині хлориду натрію, а потім вносять у безкольоровий вогонь горілки. Спостерігається забарвлення вогню в жов-
тий колір.
Забарвлення вогню, тобто здатність атомів збуджуватись і випускати кванти світла визначеної довжини хвилі при прокалюванні солей міне-
ральних речовин на вогні, використовується в методі полум’яної фотометрії для визначення йонів натрія в плазмі крові, еритроцитах, сечі та тканинах.
Визначення йонів K+ по кольору полум’я
Краплю розчину солі калію вносять на кінчику платинової дротини (попередньо дротину очистити концентрованою соляною кислотою та про-
калити) у безкольорове полум’я спиртівки та спостерігають зміну забарв-
лення полум’я у фіолетовий колір. Так визначають наявність йонів калію в біологічних рідинах та тканинах. Ефект забарвлення полум’я використо-
вується в методі фотометрії.
Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
В питних водах йони хлору знаходяться у вигляді солей: NaCl, KCl, CaCl2, MgCl2.
Аргентометричний метод дає позитивні результати, якщо у воді знаходиться не більше 2–3 г хлор-йона в 1 мл.
Для визначення вмісту хлор-йона в питній воді переносять піпеткою в колбу для титрування 10 мл досліджуваної води, додають 10 мл титро-ваного розчину нітрату аргентуму, 1 мл насиченого розчину ферумамо-
нійних галунів та титрують розчином NH4CSN до появи рожевого забарв-
лення, титрування повторюють 2–3 рази.
Вміст хлор-йона розраховують за формулою:
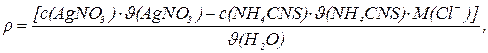
де r(Cl–) – масова концентрація хлор-йона, мг/л;
M(Cl–) – молярна маса йонів хлору, мг/моль;
J(H2O) – об’єм досліджуваної води, л;
с(AgNO3) – молярна концентрація розчину AgNO3, моль/л;
с(NH4CNS) – молярна концентрація розчину NH4CNS, моль/л;
J(AgNO3) – об’єм титрованого розчину AgNO3, л;
J(NH4CNS) – об’єм титрованого розчину NH4CNS, л.
2. АНАЛІТИЧНІ РЕАКЦІЇ НА р-ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
Серед р-елементів п’ять елементів є органогенними (“елементи жит-
тя”): вуглець, азот, кисень, фосфор, сірка, які складають основу біологічно важливих молекул. До біогенних елементів відносяться також хлор та йод, а бор, фтор та бром наявні в живих організмах у мікрокількостях. Сполуки плюмбуму та арсену мають дуже токсичні властивості. Як правило, в живому організмі р-елементи входять до складу складних органічних макромолекул або йонів OH–, Cl–,  ,
, 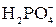 ,
, 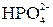 ,
,  , F–. Вони складають основу буферної системи крові, забезпечують необхідний осмо-
, F–. Вони складають основу буферної системи крові, забезпечують необхідний осмо-
тичний тиск, містяться в шлунковому соці та інших біологічних середови-щах. Багато сполук р-елементів використовуються в якості лікарських засобів.
Реакція на бор (ІІІ) по кольору полум’я
У фарфоровій чашці випаровують 5–6 крапель розчину бури. Після охолодження до сухого залишку добавити 4–5 крапель концентрованого розчину Н2SO4 та 5–6 крапель етилового спирту. Суміш перемішати скляною паличкою та підпалити. Полум’я спирту, який горить, забарв-
люється в зелений колір. Це забарвлення обумовлене летким етиловим ефіром борної кислоти В(ОС2Н5)3. Його отримують дією сірчаної кислоти та етилового спирту на тетраборат натрію:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
H3BO3 + 3C2H5OH = B(OC2H5)3 + 3H2O,
За допомогою цих реакцій перевіряються такі лікарські препарати, як борна кислота та ії солі.
Реакція на йон  з розведеними кислотами
з розведеними кислотами
У пробірку налити 0,5 мл розчину Na2CO3 або K2CO3 та додати туди 1–2 краплі розчину кислоти. Що при цьому спостерігається? Написати рівняння реакції в молекулярній та йонній формі. Ця реакція вико-
ристовується в санітарно-гігієнічній практиці при визначенні таких ком-
понентів, як СО 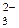 та HCO
та HCO 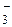 у звичайних та стічних водах.
у звичайних та стічних водах.
Реакція на йон Pb2+ з йодидом калію
До декількох крапель розчину солі плюмбуму прилити стільки ж розчину йодиду калію. Випадає жовтий осад йодиду плюмбуму.
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Pb2+ + 2I– = PbI2
До осаду прилити 1 мл оцтової кислоти та суміш нагріти до кипіння. Розчин повільно охолоджується. При цьому знов випадає осад йодиду плюмбуму у вигляді золотистих зерен.

Реакція на йон 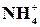 з реактивом Несслера
з реактивом Несслера
На предметне скло нанести на відстані (0,5–1)×10–2 м один від одного по одній краплі розчину NH4Cl та реактиву Несслера. З’єднати краплі за допомогою скляної палички – випадає червонувато-бурий осад:

При дуже малих кількостях солей амонію замість осаду утворюється жовтий розчин. Цей ефект використовується у колориметричному методі аналізу для визначення загального та залишкового азоту крові, сечовини, у санітарно-гігієнічній практиці – при аналізі води, повітря, харчових про-
дуктів.
Реакція на йон 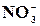 з сульфатом феруму (ІІ) в присутності концентрованої сірчаної кислоти
з сульфатом феруму (ІІ) в присутності концентрованої сірчаної кислоти
На предметне скло нанести краплю розчину нітрату натрію, у середи-
ну краплі помістити маленький кристалик FeSO4×7H2O. На нього нанести одну краплю (за допомогою крапельниці) концентрованої соляної кислоти. Навколо кристалика з’являється буре забарвлення:
3 FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO
3Fe2+ + 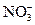 + 4H+ = 3Fe3+ + 2H2O + NO
+ 4H+ = 3Fe3+ + 2H2O + NO
FeSO4 + NO = [ Fe(NO)]SO4
Fe2+ + NO +  = [Fe(NO)]SO4
= [Fe(NO)]SO4 
Реакція на йон 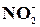 з йодидом калію
з йодидом калію
Краплю розчину нітриту калію або натрію розбавити до 3 мл водою, а потім добавити по одній краплі розчинів КІ, сірчаної кислоти та декілька крапель розчину крохмалю. Що при цьому бачимо?
Рівняння реакції:
2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2H2O + 2Na2SO4
2NO2- + 2I- + 4H+ = 2NO + I2 + 2H2O
Реакція використовується для перевірки фармакопейного препарату NaNO2.
Реакція на йон 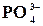 з молібдатом амонію
з молібдатом амонію
У пробірку налити 0,5 мл розчину Na2HPO4 та 0,5 мл розчину (NH4)2MoO4. Суміш підігріти. Що бачимо при охолодженні? Рівняння реакції:
12(NH4)2MoO4 + Na2HPO4 + 23HNO3 = (NH4)3H4[P(Mo2O7)6] +
+ NaNO3 + 10H2O + 21NH4NO3
Вказана реакція застосовується для визначення фосфору в ортофос-
фатах, які розчинені у водах промислових відходів.
(Для визначення фосфору в біологічних рідинах використовується реакція з молібденовою кислотою за присутністю якогось відновлювача).
Аналітична реакція на арсен (ІІІ)
Ця реакція базується на отриманні гідроген арсену (ІІ), який віднов-
лює солі аргентуму до металічного срібла. У пробірку налити 0,5 мл роз-
чину розбавленої сірчаної кислоти та краплю розчину солі арсену. Щіль-
но закрити пробірку фільтрувальним папером, змоченим 1–2 краплями розчину нітрату аргентуму, потім, трохи піднявши папір, внести у про-
бірку кусок гранульованого цинку і знову швидко закрити отвір пробірки. Через декілька хвилин на внутрішній стороні фільтрувального паперу з’являється характерна пляма жовтого, коричневого або чорного кольору – в залежності від концентрації арсена в розчині:
2Na3AsO3 + 6Zn + 9H2SO4 = 2AsH3 + 6ZnSO4 + 3Na2SO4 + 6H2O
 + 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O
+ 3Zn +9H+ = AsH3 + 3Zn2+ + 3H2O
AsH3 + 6AgNO3 + 3H2O = H3AsO3 + 6Ag +6HNO3
AsH3 + 6Ag+ + 3H2O = H3AsO3 + 6Ag +6H+
Ця реакція використовується для визначення арсену в біологічних матеріалах та водах, забруднених промисловими відходами.
Реакція на йон Ві3+ з йодидом калію
До 0,5 мл розчину солі бісмуту добавити 2–3 краплі розчину КІ. Ви-
падає чорно-коричневий осад йодиду бісмуту:
Ві(NO3)3 + 3KI = BiI3 + 3KNO3
Bi3+ + 3I– = BiI3
До одержаного осаду прилити ще (надлишок) розчину КІ та збовтати. Осад розчиняється з утворенням комплексної солі оранжевого кольору:
BiI3 + KI = K[BiI4]
BiI3 + I– = [BiI4]–
Реакція використовується для перевірки фармакопейного препарату ВіONO3.
Реакція на йон 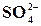 із розчином хлориду барію
із розчином хлориду барію
У пробірку налити 5 мл розчину K2SO4, Na2SO4 або H2SO4 та 1 мл розчину ВаСl2. Скласти рівняння реакції. Впевніться, що осад, який утворюється, не розчинний у HNO3 і HCl.
Реакція використовується для визначення йонів  в звичайних та стічних водах.
в звичайних та стічних водах.
Реакція на йон 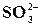 із розчином мінеральної кислоти
із розчином мінеральної кислоти
У пробірку налити 0,5 мл розчину K2SO3 або Na2SO3, 1 мл розчину HCl та нагріти. Виділяється сірчистий газ з характерним запахом. Записати рівняння цієї реакції.
Реакція на йон 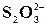 із розчином мінеральної кислоти
із розчином мінеральної кислоти
У пробірку налити 0,5 мл розчину Na2S2O3 та 1 мл розчину HCl. Трохи підігріти. Що при цьому бачимо? Рівняння реакції:
Na2S2O3 + 2HCl = S + SO2 + H2O
 +2H+ = S +SO2 + H2O
+2H+ = S +SO2 + H2O
Приведена реакція лежить в основі існуючого методу лікування сверблячки.
Реакція на йон 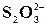 із розчином йоду
із розчином йоду
У пробірку налити 0,5 мл розчину Na2S2O3 та декілька крапель розчину йоду. Розчин йоду знебарвлюється.
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
 + I2 =
+ I2 = 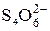 + 2I–
+ 2I–
За допомогою вказаної реакції встановлюються фармакопейні пре-
парати йоду та тіосульфату.
3. АНАЛІТИЧНІ РЕАКЦІЇ НА ЙОНИ d-ЕЛЕМЕНТІВ
ТА ЇХ СПОЛУКИ
При порівнянні з розглянутими раніше s-елементами, d-елементи міс-
тяться в організмі у значно менших кількостях. Однак їх роль у фізіоло-гічних та патологічних процесах значна. У теперішній час іде дискусія чи рахувати хром та ванадій біометалами. Біометали – незамінні мікро-
елементи, роблять каталітичний вплив на багаточисельні біохімічні реак-
ції, активізують діяльність ферментів. У макрокількостях вони отруйні. Особливу загрозу становлять сполуки меркурію. Сполучають обидві краплі за допомогою скляної палички – утворюється жовтий кристалічний осад:
2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2NaCl
2K+ + Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6]
Реактив не може бути застосований в лужному або кислому розчині внаслідок руйнування комплексного йону:
[Co(NO2)6]3– + 3OH– = Co(OH)3 + 6NO 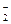
[Co(NO2)6]3– + 6H+ = Co3+ + 6HNO 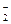
Цією реакцією користуються для осадження йонів калію в біологічних рідинах при перманганатометричному визначенні калію в них (кількість йонів калію в осаді визначається після розчинення шляхом титрування йонів NO 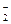 перманганатом калію).
перманганатом калію).
Реакція на йон Mg2+ з гідрофосфатом натрію Na2HPO4 у присутності водного розчину аміаку та хлориду амонію
У пробірку наливають 0,5 мл розчину солі магнію, а потім додають туди у вказаній послідовності по 0,5 мл таких розчинів: NH4Cl, NH3ОН та Na2HPO4. При цьому випадає білий дрібнокристалічний осад подвійної солі MgNH4PO4:
MgCl2 + Na2HPO4 + NH3 = MgNH4PO4 + 2 NaCl
Mg2+ + HPO 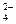 + NH3 = MgNH4PO4
+ NH3 = MgNH4PO4
Присутність NH4Cl в розчині необхідна для того, щоб запобігти утворенню гідроксиду магнію за рівнянням реакції:
Mg2+ + 2NH3 + 2H2O = Mg(OH)2 + 2NH 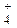 ,
,
збільшення NH 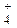 зміщує дану рівновагу вліво та йони Mg2+, завдяки цьому, залишаються в розчині.
зміщує дану рівновагу вліво та йони Mg2+, завдяки цьому, залишаються в розчині.
Отриманий осад розділити на дві частини та перевірити його роз-
чинність у соляній та оцтовій кислотах. Реакції проходять за рівняннями:
MgNH4PO4 + 3HCl = MgCl2 + NH4Cl + H3PO4
MgNH4PO4 + 3H+ = Mg2+ +  + H3PO4
+ H3PO4
або
MgNH4PO4 + 2CH3COOH = Mg(CH3COO)2 + NH4H2PO4
MgNH4PO4 + 2CH3COOH = Mg2+ +  + 2CH3COO- + H2PO
+ 2CH3COO- + H2PO 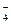
Реакція утворення MgNH4PO4 застосовується в біохімічному аналізі для визначення йонів Mg2+ у крові та тканинах.
Реакція на йон Са2+ з оксалатом амонію (NH4)2C2O4
У пробірку наливають 0,5 мл розчину солі кальцію і таку ж кількість розчину (NH4)2C2O4. Утворюється білий кристалічний осад:
СаСl2 + (NH4)2C2O4 = CaC2O4 + 2 NH4Cl
Ca2+ + C2O42- = CaC2O4
Осад розділяють на дві частини та випробовують його на розчинність в соляній та оцтовій кислотах. В якій кислоті осад розчиниться? Записують рівняння хімічної реакції. Розглянута реакція застосовується для визна-
чення загального вмісту йонів кальцію у крові, сечі та тканинах.
Реакція на йон Ва2+ з хроматом калію К2СrO4
Налити в пробірку 0,5 мл розчину солі барію та 0,5 мл розчину хромату калію. Випадає жовтий кристалічний осад хромату барію:
ВаCl2 + K2CrO4 = BaCrO4 + 2KCl
Ba2+ + CrO42- = BaCrO4
Отриманий осад розділити на дві частини і перевірити його роз-
чинність в соляній та оцтовій кислоті. У соляній кислоті осад розчиняється за рівнянням
2 BaCrO4 + 2HCl = BaCl2 +BaCr2O7 + H2O
2 BaCrO4 + 2H+ = 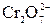 + H2O
+ H2O
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 555; Нарушение авторских прав?; Мы поможем в написании вашей работы!