
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Експериментальна частина 1 страница
|
|
|
|
Відкриванням водопровідного крана пускають воду в калориметр. Користуючись міткою на крані l, повертають його так, щоб, виходячи із калориметра, вода попадала у відлив.
Підпалюють сухий спирт і протягом 10–15 хвилин дома-
гаються сталості температур вхідної і вихідної води, весь час спосте-
рігаючи за горінням спирту. Температуру вхідної і вихідної води спостерігають на обох термометрах і записують через кожну хвилину протягом 5 хвилин. З одержаних даних знаходять середню температуру води. Потім повертають головку крана так, щоб вода витікала в циліндр Z ємністю 1 літр. Коли в циліндр витече 1 літр води, кран перекривають. По масі сухого спирту, що згорів, і масі води, що набрана в циліндр, і різниці в показниках термометра розраховують теплотворну здатність речовини. Для розрахунків необхідно знати також і барометричний тиск, пружність парів води при заданій температурі і кімнатну температуру.
Кількість тепла (в Дж), яке пішло на нагрівання води при згоранні певної маси речовини розраховують по формулі
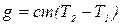 ,
,
де т – маса води, кг; С – теплоємність води, Дж/кмоль; Т1 – температура води (К) на вході калориметра; Т2 – температура води (К) на виході з калориметру.
Калорійність сухого спирту, розрахована на 1 кг, знаходять по формулі
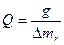 103.
103.
Дослід проводять при різній швидкості протікання води і вираховують середнє значення теплотворної здатності сухого спирту. Режим роботи вказується керівником заняття. Запис ведеться за такою формою (див. табл. 1):
| m = g = H = | h = Т, К = Q = |
Таблиця 1
| Початкова маса mo, к г | Кінцева маса mt, к г | ∆mr, к г | Температура води, Т К | Середня темпе- ратура води, Т К | ||
| що входить | що виходить | що входить | що виходить | |||
Пружність парів води в залежності від температури наведена в
табл. 2.
Таблиця 2
| Т К | h, мм рт.ст. | Т К | h, мм рт.ст. |
| 287,0 | 11,987 | 292,5 | 16,99 |
| 287,5 | 12,382 | 293,0 | 17,535 |
| 288,0 | 12,783 | 293,5 | 18,085 |
| 288,5 | 13,205 | 294,0 | 18,650 |
| 289,0 | 13,634 | 294,5 | 19,231 |
| 289,5 | 14,076 | 295,0 | 19,827 |
| 290,0 | 14,530 | 295,5 | 20,440 |
| 290,5 | 14,997 | 296,0 | 21,068 |
| 291,0 | 15,477 | 296,5 | 21,714 |
| 291,5 | 15,971 | 297,0 | 22,377 |
| 292,0 | 16,477 | 298,0 | 23,765 |
2. ВИЗНАЧЕННЯ ТЕПЛОТИ РОЗЧИНЕННЯ І ТЕПЛОТИ ГІДРАТАЦІЇ СОЛІ
Для роботи необхідно: калориметр; термометр; мішалка; пробірка для солі; дистильована вода; секундомір; сіль для розчинення; джерело струму; амперметр; вольтметр; електрообігрівач.
Мета роботи:
1. Визначення теплоємності калориметричної системи методом електро-
обігріву.
2. Визначення питомої теплоємності розчинення солі.
3. Визначення інтегральної теплоти розчинення, тобто теплового ефекту розчинення одного моля солі в такій кількості розчинника, коли Q буде постійним – Q інт.
4. Визначення теплоти гідратації солі – питомої і віднесеної до одного моля солі.
Тепловий ефект розчинення солі в великій кількості води дорівнює двом тепловим ефектам: зміні тепловмісту солі при руйнуванні криста-
лічної гратки Q 1, що зв’язано з поглинанням тепла і зміною тепловмісту при розчиненні частинок у розчиннику, що зв’язано з виділенням тепла Q 2:
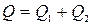 .
.
В залежності від співвідношення величин відповідних ефектів, тепло-
вий ефект розчинення може мати додатне або від’ємне значення. Тепловий ефект розчинення солей у воді здебільшого ендотермічний, тобто процес розчинення супроводжується поглинанням тепла і температура розчину понижується. Дуже рідко спостерігається екзотермічний тепловий ефект. Теплота розчинення заданої солі в заданому розчиннику може змінюва-
тися, якщо змінювати кількість взятої солі і розчинника.
Визначивши теплоти розчинення солей, можна визначити і теплоту гідратації солі. Теплотою гідратації називають кількість тепла, яку сис-
тема повинна одержати для утворення одного грам-моля твердого крис-
талогідрату з твердої безводної солі і відповідної кількості води. Якщо визначити послідовно тепловий ефект розчинення твердої безводної солі і тепловий ефект розчинення кристалогідрату, то із різниці можна знайти теплоту гідратації
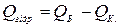 ,
,
Q Б. – тепловий ефект розчинення безводної солі;
Q К. – тепловий ефект розчинення кристалогідрату з молекули води.
Для визначення теплоти розчинення користуються калориметром з електрообігрівачем. При визначенні теплоємності системи виходять з того, що на систему подають певну кількість тепла електрообігрівом Qтеор. і відраховують зміну температури D t.
Для проведення експерименту збирають прилад (калориметр). У склян-ку наливають 300 г дистильованої води (тобто 300 мл, враховуючи, що густина води при температурі досліду приблизно дорівнює 1). Склянку з мішалкою ставлять у калориметр і закривають кришкою. На кришці калориметру закріплена спіраль для обігріву. Зважують певну кількість солі (на технічних терезах), висипають її в суху пробірку і вставляють у калориметр через отвір на кришці, щоб сіль прийняла температуру калориметричної установки. (Сіль і наважка солі вказується керівником заняття). Коли калориметрична установка зібрана, починають налагод-
жувати термометр Бекмана. Термометр занурюють у воду через отвір на кришці і спостерігають за рівнем ртуті в капілярі. Рівень ртуті повинен знаходитись у нижній частині шкали. (Термометр не повинен торкатись спіралі, стінок стакану, пробірки і мішалки). Якщо рівень ртуті вищий одного градуса, або весь капіляр заповнений ртуттю, то це означає, що її багато в нижньому резервуарі і надлишок її необхідно перелити у верхній резервуар.
 Для цього термометр ставлять похило, щоб нижній резервуар знахо-
Для цього термометр ставлять похило, щоб нижній резервуар знахо-
дився вище верхнього, і трошки підігрівають (торкнувшись рукою ниж-
нього резервуару). Коли частина ртуті перейде у верхній резер-
вуар, стовпчик ртуті розривають. Для цього затискують нижній кі-
нець термометра в руці і легким постукуванням руки по столу роз-
ривають ртуть у капілярі. Пере-
ливання роблять до тих пір, поки при даних умовах ртуть не зупи-
ниться в середині шкали термо-
метра Бекмана. Якщо ртуть зна-
ходиться нижче поділок шкали або зовсім не заповнює капіляр, отже при даних умовах ртуті недостатньо і її потрібно пере-
лити із верхнього в нижній резер-
вуар, тоді швидко перегортають термометр верхнім резервуаром вниз і з’єднують ртуть. Потім обережно перегортають термометр, тримаючи його похило, так, щоб запасний резервуар знаходився вище основного. Коли необхідна кількість ртуті перейде з верхнього резервуару в нижній, стовпчик ртуті розривають, як вказано вище.
Налагоджений термометр вставляють у прилад і приступають до складання електричної схеми (рис. 1). Джерело струму включається тільки після перевірки електричної схеми керівником занять.
Після цього приступають до виконання експерименту. Переміщуючи рідину в калориметрі, включаючи секундомір, починають відлік темпе-ратури по термометру. Температура змінюється внаслідок теплообміну із зовнішнім середовищем. Відлік ведуть кожні півхвилини протягом
5 хвилин – це початковий період. Записавши час і покази термометра останнього відліку початкового періоду, включають струм на 3 хвилини і продовжують відлік через кожні півхвилини. При цьому для рівномірного обігріву води в стакані проводять її перемішування. Починаючи з часу включення струму, проходить нерівномірна зміна температури. Струм відключають і рівномірне падіння температур відраховують протягом
5 хвилин (через кожні півхвилини) – це кінцевий період.
Вмикання і вимикання струму проводять три рази і кожного разу записують покази приладів. Після третього вимикання струму, продов-
жуючи відлік, швидко висипають сіль з пробірки в стакан з водою і енергійно перемішують. При цьому сіль буде швидко розчинятись. Для більш точного визначення D t нагрівання і D t розчинення результати трьох періодів і чотирьох циклів безперервного відліку зміни температури з часом (три цикли і один цикл розчинення солі) заносяться на графік рис. 2.
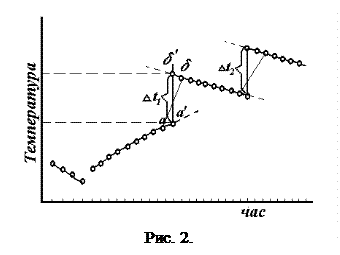 По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа-
По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа-
грами. Проміжок часу голов-
ного періоду ділять пополам і з цієї точки проводять пряму, па-
ралельну осі ординат до пе-
ретину з обома екстрапольо-
ваними прямими. Відрізок між двома точками перетину відповідає підвищенню температури D t для даного циклу. Аналогічно знаходять D t для всіх циклів досліду.
Дійсну температуру D tнар. знаходять як середнє арифметичне
 .
.
D t розчинення визначають аналогічно. Якщо після нагрівання на шкалі термометра далі не можна заміряти зміну температури розчинення солі, то дослід після нагрівання зупиняють. Термометр налагоджують на відповідні поділки шкали і проводять цикл розчинення солі.
Знаючи D t нагрівання, вираховують кількість тепла, яка одержана водою під час її нагрівання
 ,
,
де с – питома теплоємність води, яку приймають за одиницю;
т – вага води, яка дорівнює її об’єму 300 мл.
Підставляючи ці значення, одержимо
 .
.
Ця кількість тепла менша за Qтеор., у зв’язку з поглинанням тепла системою. Qтеор. можна розрахувати, виходячи з закону Джоуля – Ленца.
 (Дж).
(Дж).
Виміряючи силу струму І в амперах, напругу U – у вольтах, а час проходження струму t – в секундах, визначають кількість тепла в джоулях.
Із розрахованої теоретичної кількості тепла віднімають кількість тепла, що одержана експериментально і різницю перераховують на 1 К. Це і буде кількість, яка поглинається всіма частинами калориметру – Ск.
Розраховують її, виходячи з пропорції
 ,
,
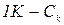 ,
,
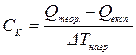 .
.
Загальна теплоємність системи дорівнює
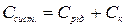 .
.
де Срід. – теплоємність калориметричної рідини, яка дорівнює:
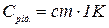 ,
,
С – питома теплоємність розчину, приблизно дорівнює одиниці. Масу розчину приймають рівною об’єму, тобто 300 мл. Тоді Срід можна прийняти рівною 1293,6 Дж, отже
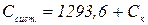 .
.
Визначивши по графіку D t розч. і розрахувавши теплоємність калориметричної системи, знаходять тепловий ефект розчинення взятої наважки солі:
 .
.
Тепловий ефект розчинення, віднесений до одного грама розчиненої речовини, дає питому теплоту розчинення:
 ,
,
де g – наважка солі в грамах. Молекулярна теплота розчинення дорівнює:
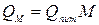 ,
,
де М – молекулярна маса солі.
Для визначення молекулярної теплоти гідратації знаходять моле-
кулярну теплоту розчинення безводної солі і кристалогідрату цієї солі. Різниця одержаних молярних теплот і буде теплотою гідратації
 .
.
Кристалогідрат розчиняють не в 0,3 кг води, а в кількості, меншій на величину, яка міститься в наважці кристалогідрату.
Правильність результатів роботи перевіряється керівником занять.
Результати досліду записуються у табл. 1 і 2:
Таблиця 1
| Наважка б/в солі,10-3 кг | Мол. маса б/в солі, кг/кмоль | Наважка криста- логідрату, 10-3 кг | Молекулярна маса кристалогідрату, кг/кмоль | Об’єм розчин- ника, 10-6м3 | Сила струму, А | Напруга, В | Час, за який проходить струм, с | Q теоретичне, Дж | Зміна температури при нагріванні, К | Середнє значення зміни температури, К | Q практичне, Дж | Теплоємність калометр. сист., Дж | |
| I1= I2= I3= Icep= | U1= U2= U3= Ucep= | t1= t2= t3= | DТ1= DТ2= DТ3= |
Таблиця 2
| Зміна температури при розчиненні, К | Теплота розчинення, Дж | Теплота гідратації, Дж | ||||||||
| б/в солі | кристалогідрату | |||||||||
| б/в солі | крис- тало-гідрату | Q | QT | QM | Q | QT | QM | Q | QT | QM |
V. ПОВЕРХНЕВІ ЯВИЩА (ПОВЕРХНЕВА ЕНЕРГІЯ, ПОВЕРХНЕВИЙ НАТЯГ ТА АДСОРБЦІЯ НА МЕЖІ РОЗДІЛУ ФАЗ)
1. ВИЗНАЧЕННЯ ПОВЕРХНЕВОГО НАТЯГУ РОЗЧИНІВ МЕТОДОМ ВІДЛІКУ КРАПЕЛЬ
(СТАЛАГМОМЕТРИЧНИМ МЕТОДОМ)
Для роботи необхідні: сталагмометр; пікнометр; стаканчик на 50 мл.
Вільна поверхнева енергія, вірніше, надлишок вільної енергії на одиницю площі поверхневого шару на межі розділу рідина – повітря, називається поверхневим натягом, а на межі розділу рідина – рідина – граничним натягом s.
Одиницями виміру поверхневого натягу може бути Дж/м2 у випадку, коли його розглядають як надлишок вільної енергії поверхні розділу двох фаз, що накопичується на цій поверхні за рахунок нескомпенсованих міжмолекулярних сил, і в Н/м у випадку, якщо розглянути роботу утво-
рення одиниці нової поверхні.
Існує декілька методів визначення поверхневого натягу.
Найбільш розповсюдженим методом є сталагмометричний (метод відліку крапель).
В основі методу лежить експериментально встановлене положення, що вага краплі, яка повільно відривається під дією сили тяжіння від кін-
чика вертикальної трубки сталагмометра, буде тим більшою, чим більший поверхневий натяг рідини на межі з повітрям.
Вважається, що сила поверхневого натягу F, що діє вертикально по колу трубки, приблизно рівна F = 2prs, підтримує краплю, зрівноважуючи її вагу P. У момент відриву краплі можна вважати ці сили рівними:
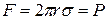 ,
,  ,
,
де F – сила поверхневого натягу; P – сила ваги краплі; s – коефіцієнт пропорційності, який зв’язує силу поверхневого натягу з периметром
(в даному випадку, з довжиною кола капіляру, з якого витікає рідина).
При 2pr = 0,01 м коефіцієнт пропорційності рівний силі поверхневого натягу, тобто 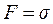 .
.
Визначення радіусу капіляру зв’язане з деякими труднощами і тому практично визначають поверхневий натяг відносно стандартної рідини з відомим поверхневим натягом. Стандартною рідиною може бути тільки така рідина, яка утворює краплі, близькі по об’єму до крапель дослід-
жуваної рідини.
При утворенні краплі сила поверхневого натягу досліджуваної речовини дорівнює F=2p rs (якщо вимірювання проводиться в одному і тому ж сталагмометрі).
Силу поверхневого натягу визначити важко, тому при експеримен-
тальних дослідженнях визначають вагу краплі, яка в момент відриву приблизно дорівнює силі поверхневого натягу.
Сила ваги одної краплі досліджуваної рідини
 ,
,
де Vр – об’єм рідини, що витікає з сталагмометра;
ρ – густина рідини;
n – число крапель досліджуваної рідини в об’ємі;
g – прискорення сили земного тяжіння.
Аналогічний вираз при одному і тому ж об’ємі приладу можна записати і для стандартної рідини
 .
.
Беруть співвідношення цих рівнянь
 .
.
А так як
 , тоді
, тоді  .
.
Розв’язавши це рівняння відносно поверхневого натягу досліджуваної речовини, одержуємо розрахункову формулу:
 ,
,
де sо, ρo – поверхневий натяг і густина стандартної рідини.
Якщо за стандартну рідину береться вода, то sо при температурі дос-
ліду беруть з табл. 2, що знаходиться в кінці опису. ρo для води приблизно дорівнює одиниці.
При досліджуванні розведених розчинів (розчини ізоамілового спирту) густину ρ також можна прийняти за 1.
Густина концентрованих розчинів хлористого натрію береться з табл. 4, а густина води в залежності від температури – з табл. 3.
При дослідженні чистих рідин їх густину необхідно визначити. n, no – число крапель стандартної і досліджуваної речовини, визначається з допо-
могою сталагмометра.

|
На рисунку схематично зображений сталагмо-
метр. Піпетка має розширену частину 1 і капіляр 2. Рідина, що витікає з сталагмометру, збирається в краплю, що звисає на нижньому, плоскому добре від-
шліфованому кінці сталагмометра. Крапля відри-
вається від поверхні диску в той момент, коли сила ваги її на незначну величину перевищує силу по-
верхневого натягу, що утримує краплю.
Визначення поверхневого натягу зводиться до відліку кількості крапель, що витікають з капіляру.
Через каучукову трубку, що знаходиться на верхньому кінці втягують рідину вище мітки. Відлік крапель починають тоді, коли рідина проходить міт-
ку. Відраховують число крапель від мітки до остан-
ньої краплини.
Спочатку проводять виміри із стандартною рідиною, якщо це вода, то немає необхідності сушити сталагмометр при переході до водних розчинів. Визначення ведуть, починаючи з розбав-
лених розчинів, переходячи до більш концентрованих. Для кожного роз-
чину визначення кількості крапель проводять не менше трьох разів і знаходять середню кількість крапель. З одержаних даних розраховують поверхневий натяг розчинів поверхнево-активних і поверхнево-неактивних речовин. Будують ізотерму поверхневого натягу в координатах  .
.
Результати досліду і розрахункові дані записуються в табл. 1.
Таблиця 1
| Кількість крапель | Густина, кг/м3 | Поверхневий натяг, Н/м×10-2 | |
| Дослід | Середнє значення | ||
Таблиця 2
Поверхневий натяг води в залежності від температури
| Т, К | Поверхневий натяг води, Н/м×10–2 |
| 75,64 | |
| 74,22 | |
| 72,75 | |
| 71,18 | |
| 69,56 | |
| 67,91 | |
| 66,18 |
Таблиця 3
Густина води в залежності від температури
| Т, К | Густина, кг/м3 | Т, К | Густина, кг/м3 | Т, К | Густина, кг/м3 |
| 1000,00 | 999,40 | 997,80 | |||
| 999,99 | 999,30 | 997,65 | |||
| 999,97 | 999,13 | 997,32 | |||
| 999,93 | 998,97 | 997,07 | |||
| 999,88 | 998,80 | 996,81 | |||
| 999,81 | 998,62 | 996,54 | |||
| 999,73 | 998,43 | 996,26 | |||
| 999,63 | 998,23 | 995,97 | |||
| 999,52 | 998,02 | 995,67 |
Таблиця 4
Густина розчинів NaCl при 293 К
| Конц. NaCl, н. | Густина, кг/м3 |
| 0,1 | 994,7 |
| 0,25 | 1003,1 |
| 0,5 | 1018,5 |
| 1,0 | 1032,8 |
2. ВИЗНАЧЕННЯ ПЛОЩІ ТА ДОВЖИНИ МОЛЕКУЛИ ПОВЕРХНЕВО-АКТИВНОЇ РЕЧОВИНИ
Для виконання роботи потрібно визначити поверхневий натяг декіль-
кох розчинів поверхнево-активної речовини різної молярної концентрації (за вказівкою викладача). Вимірювання поверхневого натягу проводять сталагмометричним методом, як описано вище.
Для визначення величини адсорбції находять різницю величини по-
верхневого натягу s2 і s1, які виміряли для двох сусідніх розчинів різної молярної концентрації с2(Х) і с1(Х). Цю різницю s2 – s1 = Ds і с2(Х) – с1(Х)=Dс(Х) підставляють у рівняння Гіббса:
 ,
,
де Г – величина адсорбції, моль/м2;
с(х) – молярна концентрація поверхнево-активної речовини, моль/м3;
R – газова стала, дорівнює 8,31 Дж/моль.К;
Т – абсолютна температура, К;
σ – поверхневий натяг, Дж/м2.
В цьому випадку в якості с(х) беруть середнє арифметичне  . Потім розраховують сср.(х) і будують графік залежності
. Потім розраховують сср.(х) і будують графік залежності  (вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.
(вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.
Одержані дані заносять в таку таблицю:
| №№ п/п | с(х), моль/м3 | σ, Дж/м2 | сср.(Х), моль/м3 | Δс(Х), моль/м3 | Δσ, Дж/м2 | Г, моль/м2 | сср.(Х) моль/м3 |
Розрахувати площу (S) і довжину (l) молекули поверхнево-активної речовини:
 ,
,
де N – постійна Авогадро, дорівнює 6,02×1023 моль–1;
Гmax – величина граничної адсорбції, моль/м2;
М(Х) – молярна маса ПАР, кг/моль;
ρ – густина ПАР, кг/м3.
3. АДСОРБЦІЯ ОЦТОВОЇ КИСЛОТИ НА АКТИВОВАНОМУ ВУГІЛЛІ
Ізотерми адсорбції ряду речовин із розчину на поверхні твердого тіла в області середніх концентрацій задовільно описуються емпіричним рів-
нянням Фрейндліха:
 , (1)
, (1)
де Х – кількість адсорбтиву, ммоль;
m – маса адсорбенту, кг;
 – величини адсорбції, кмоль/кг;
– величини адсорбції, кмоль/кг;
К і  – емпіричні константи, залежні від природи адсорбенту і адсорбативу;
– емпіричні константи, залежні від природи адсорбенту і адсорбативу;
с – рівноважна молярна концентрація адсорбативу, моль/м3.
Величина адсорбції 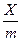 або а розраховується за формулою:
або а розраховується за формулою:
 . (2)
. (2)
Якщо прологарифмуємо рівняння (1), то воно набуде вигляду:
 . (3)
. (3)
Одержане рівняння є рівнянням прямої лінії.
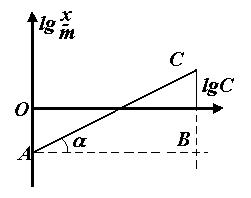 Для визначення К і
Для визначення К і 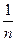 находять логарифми значень с і
находять логарифми значень с і 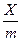 і будують графік (див. рисунок: по осі абсцис lg c, а по осі ординат lg
і будують графік (див. рисунок: по осі абсцис lg c, а по осі ординат lg 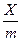 ). Величина відрізку АО дорівнює lg K. За значенням логарифму находять К. Постійна
). Величина відрізку АО дорівнює lg K. За значенням логарифму находять К. Постійна 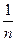 дорівнює tg α або відношенню довжин відрізків СВ і АВ, тобто
дорівнює tg α або відношенню довжин відрізків СВ і АВ, тобто  .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 521; Нарушение авторских прав?; Мы поможем в написании вашей работы!