
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Завдання 3. Одержання водню з розчину лугу
|
|
|
|
Покладіть у пробірку кілька кусочків алюмінієвих ошурок, додайте розчину NаОН, закріпіть пробірку в затискачі штатива, закрийте її корком з відтягнутою трубкою і спостерігайте перебіг реакції. Спочатку реакція відбувається повільно, а потім досить бурхливо. Доведіть, що в результаті реакції виділяється водень. Напишіть рівняння реакції.
Завдання 4. Відновні властивості водню в момент виділення
Налийте в дві пробірки по 1-2 см  розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
Завдання 5. Вивчення взаємодії лужних та лужноземельних
металів з водою
У три пробірки налийте 1-2 см  води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
Завдання 6. Забарвлення полум'я йонами лужних та
лужноземельних металів
Внесіть дротинку з нержавіючої сталі з петлею на кінці в полум'я пальника і прожарте її до припинення забарвлення полум'я. Охолоджену дротинку змочіть у розчині відповідної солі або занурте в кристали цієї солі і внесіть у полум'я пальника. Відмітьте колір полум'я і занесіть його в таблицю. Дротинку прожарюйте, доки забарвлення не зникне, після чого проведіть дослід з наступною сіллю.
Таблиця
Колір полум'я, викликаний йонами лужних та лужноземельних металів.
| Йони лужних металів | Йони лужноземельних металів | ||
| Йон | Колір полум’я | Йон | Колір полум’я |
| Li+ | 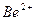
| ||

| 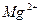
| ||

| 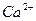
| ||
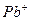
| 
| ||
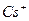
| 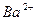
|
Зробіть відповідні висновки.
Завдання 7. Утворення та усунення карбонатної твердості води
У пробірку до половини її об'єму налийте вапняної води і опустіть в неї газовідвідну трубку від апарата Кіппа, зарядженого мармуром і хлоридною кислотою. Пропускайте в розчин несильний струмінь газу і слідкуйте, щоб розчин не викидало цим струменем із пробірки. Відмітьте появу осаду кальцію карбонату. Продовжуйте пропускати СО2 до повного розчинення осаду, який супроводжується утворенням кальцію гідрокарбонату Са(НСО3)2. Напишіть рівняння реакції. Як називається вода, що містить кальцію гідрокарбонат?
Отриманий розчин розділіть на дві пробірки:
· Половину отриманого розчину обережно нагрійте до кипіння і утворення осаду кальцію карбонату. Напишіть рівняння реакції розкладу Са(НСО3)2 при кип'ятінні.
· До другої половини розчину добавте декілька крапель розчину NаОН до утворення осаду СаСO3. Напишіть рівняння реакції.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!