
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правила номенклатури IUPAC
|
|
|
|
1. У молекулі визначається найдовший нерозгалужений ланцюг атомів Карбону.
2. Він нумерується таким чином, щоб виконувалось «правило локантів» (це стосується алканів), а для всіх інших органічних функціональних похідних нумерація іде з того кінця ланцюга, до якого ближче розташована функціональна група.
3. У ланцюгу визначають місце знаходження бічних відгалужень (алкілів); ці бічні замісники перераховуються в порядку зростання молекулярної маси з позначенням знаходження кожного замісника в ланцюгу відповідним локантом і префіксом, що відповідає кількості однакових замісників.
4. У кінці назви вказується назва основного ланцюга.
5. У випадку деяких функціональних похідних, залежно від типу функціональної групи, її місцезнаходження і тип позначаються або префіксом або суфіксом.

3,4,4,10-Тетраметил-5-етил-7-ізопропілундекан
 Σ =3+4+4+5+7+10=17
Σ =3+4+4+5+7+10=17
 Σ=2+5+7+8+8+9=19
Σ=2+5+7+8+8+9=19
Правило локантів: нумерація ланцюга ведеться таким чином, щоб сума локантів була найменшою.
Приклад контрольного завдання:
За назвою сполуки записати формулу і визначити правильність назви.
4-Метил-2,4-діетилоктан

3,5-Диметил-5-етилнонан
5.5. Методи добування алканів
Ці методи можна умовно поділити на групи за ознакою зміни довжини карбонового ланцюга вихідної сполуки, порівняно з ланцюгом кінцевого алкану.
І. Способи подовження карбонового ланцюга.
1. Реакція Вюрца – взаємодія галогенопохідних з металічним натрієм:
а) реакція включає одну галогенопохідну:

б) реакція Вюрца для суміші двох галогенопохідних (R, R'):
R– один залишок;
Hal– будь-який Hal (I, Br, Cl):
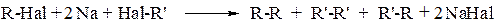
Приклад:

2. Реакція Кольбе – електроліз водних розчинів натрієвих або калієвих солей карбонових кислот:
|
|
|
а) дисоціація солі карбонової кислоти:

б) власне електроліз:

R·– радикал,
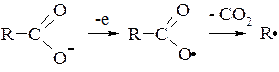
в) рекомбінація радикалів:

Приклад скороченого запису реакції Кольбе:
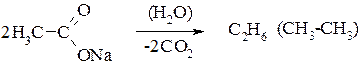
ІІ. Методи добування алканів зі збереженням довжини карбонового ланцюга.
1. Взаємодія галогенопохідних з йодоводневою кислотою
(НІ – відновник):
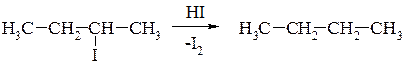
2. Гідрогенізація (гідрування) ненасичених сполук:

ІІІ. Методи добування алканів зі скороченням карбонового ланцюга вихідної сполуки.
Реакція Дюма — сплавлення натрієвих або калієвих солей карбонових кислот з твердими їдкими лугами (декарбоксилювання солей карбонових кислот):
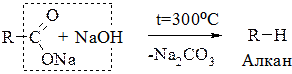
5.6. Хімічні властивості алканів
У складі молекул алканів є зв’язки типу С–Н, вони належать до σ -зв′язків, тому є міцними, а значить малореакційноздатними, цим і обумовлюється інертність алканів за звичайних умов. Для того щоб алкани вступили в реакцію, необхідно надати їм значну порцію енергії (теплової, променевої, тощо). При цьому полярні зв’язки розриваються дещо легше і реагують у м’якіших умовах. Цим зумовлена група реакцій заміщення атомів Гідрогену в молекулах алканів:
1. Галогенування.

У першу чергу заміщення Гідрогену відбувається біля третинного атома Карбону.
2. Нітрування (Реакція Коновалова).
Дія розбавленої нітратної кислоти HNO3 при підвищеному тиску і підвищеній температурі. Порядок заміщення такий, як і при галогенуванні:

3. Сульфування.
Відбувається в першу чергу при вторинному атому Карбону, не зачіпаючи третинний. Це зумовлено порівняно великим об’ємом сульфогрупи і створюваними нею просторовими перешкодами при підході до третинного атома Карбону:

5.7. Окремі представники
Метан є основною складовою природного газу. Крім того, він міститься в кам’яновугільних пластах – під час їхньої розробки утворюються вибухонебезпечні суміші метану з повітрям, так званий «рудниковий газ». Метан разом з оксидом Карбону (ІV) міститься в болотному газі, який утворюється на дні озер і на болотах унаслідок анаеробного (метанового) бродіння целюлози.
|
|
|
Необхідний для промислових потреб метан виділяють з природного газу, добувають при крекінгу нафти. Можливий також синтез метану при взаємодії оксидів Карбону з воднем:

Метан – безбарвний, неотруйний газ, який не має запаху. На повітрі або в атмосфері кисню він горить блакитним полум’ям. Його суміш з повітрям або киснем – вогне- та вибухонебезпечна.
Метан має різноманітне застосування у промисловості. У складі природного, світильного та біогазів він використовується для виділення тепла. У разі часткового окиснення метану або в результаті його термічного розкладу добувають сажу, яка використовується як наповнювач у виробництві гуми:

Метан використовується для синтезу цілого ряду важливих сполук, таких як метанол, синильна кислота, етин (ацетилен), хлорометан, дихлорометан, хлороформ, тетрахлорометан, сірковуглець, формальдегід тощо.
Етан, як і метан, виділяють із природного газу або газів крекінгу. Лабораторними методами його синтезують за реакцією Вюрца, електролізом натрійетаноату (реакція Кольбе).
Етан – горючий, безбарвний газ, який не має запаху, як і метан, він використовується для виділення тепла, а також для синтезу важливих сполук (хлороетану, етену тощо).
Бутан міститься в природному газі та нафті й утворюється в процесах крекінгу.
За звичайних умов н-бутан та ізобутан – газоподібні, однак вони легко конденсуються. Як і інші алкани використовується для виділення тепла. Крім того, вони використовується для синтезу ненасичених вуглеводнів (1-бутену,
2-бутену, ізобутену, 1,3-бутадієну). [1], c. 133-145; [2], с. 203-228.
Контрольні запитання та завдання
1. Напишіть можливі структури загальної формули С6Н14. визначте первинні, вторинні, третинні та четвертинні атоми Карбону у кожному ізомері. Назвіть ізомери за номенклатурою IUPAC.
2. Напишіть структурні формули сполук, які містять такі радикали: а) два ізопропільні; б) один ізобутил; в) один втор -бутил; г) два трет -бутили; д) ізопропіл та втор -бутил; е) трет -бутил та ізобутил; є) метил, етил, н -пропіл та втор -бутил.
3. Напишіть рівняння наведених реакцій та вкажіть назви усіх органічних сполук
(М — метил; Et — етил):
|
|
|
а) втор -бутилбромід + Na  ?
?
б) М–І + Na + Et–І  ?
?
в) трет -бутилбромід + Mg/етер  ?
?
г) ізопропілмагнійбромід + Н2О  ?
?
д) EtСОО2¯ + е  ?
?
е) EtСОО¯Na+  ?
?
4. Розмістіть наведені вуглеводні у порядку зменшення їх температур кипіння:
3,3-диметилпентан; гептан; 3-метилгептан; н -пентан; 3-метилгексан.
5. Яку будову має алкан з молекулярною масою 72, якщо під час монохлорування утворюється лише один продукт?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1587; Нарушение авторских прав?; Мы поможем в написании вашей работы!