
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова молекули бензену
|
|
|
|
Молекула бензену складається з шести атомів Карбону і шести атомів Гідрогену. Довгий час залишалися невідомими хімічна природа і будова молекули бензену.
Як дуже ненасичена сполука (С6Н6) порівняно з С6Н14, він проявляє властивості насичених вуглеводнів:
· не знебарвлює бромну воду і розчин калійперманганату;
· при певних умовах вступає в реакції заміщення.
Було встановлено, що однозаміщені С6Н5Х не мають ізомерів, що свідчить про рівноцінність всіх атомів Гідрогену та Карбону. Вперше формулу будови бензену було запропоновано в 1865 р. німецьким хіміком Августом Кекуле.
Для встановлення порядку хімічних зв’язків, що відповідають цій формулі, пропонувалося кілька десятків структурних формул, наприклад:



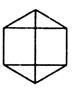



Структура Структура Структура Структура Структура
Ладенбурга Дюара Амстронга– Клауса Тіле
Байєра

Структура Кекуле
З усіх наведених формул дійсно відповідають реальній будові молекули C6H6 і найкраще її описують дві останні формули. Кожна з них має свої переваги і недоліки.
Молекула C6H6 є плоским шестикутником, у вершинах якого знаходяться атоми Карбону в стані sp2-гібридизації (що зумовлює плоску будову молекули).
Кожен з атомів Карбону за рахунок своїх sp2-гібридних орбіталей сполучається з двома сусідніми атомами Карбону в циклі, а також із атомом Гідрогену, негібридизовані р -орбіталі від кожного з шести атомів Карбону зорієнтовані перпендикулярно площині шестикутника; таким чином, у площині шестикутника утворюються σ-зв’язки, а над і під площиною кільця негібридизовані р -орбіталі перетинаються за принципом утворювання
π-зв’язків, але вони при цьому утворюються не з окремих π-зв’язків (перетинаються не попарно), а утворюють суцільну π-електронну циклічну хмарину, що характеризуються зі стереометрії як тор (бублик), тобто над і під площиною кільця молекули C6H6 знаходяться дві тороїдальні хмарини π-електронної густини.
Будову системи σ-зв’язки та π-зв’язків у молекулі бензену можна відобразити такими схемами׃

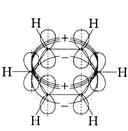
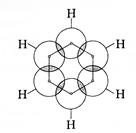
Вигляд збоку Вигляд зверху
У вказаній π-електронній системі молекули бензену електронна густина розподілена абсолютно рівномірно між усіма атомами Карбону, а кожен
р- електрон не «прив’язаний» жорсткодо «свого» карбонового атома, а знаходиться у сумісному користуванні всіх шести атомів Карбону.
Такий розподіл (урівномірнений, урівноважений) між кількома атомами Карбону називається делокалізацією електронної густини. В такій системі, що формально складається з чергованих подвійних і простих зв’язків, довжина яких відповідно (0,134 нм) і (0,154 нм), в дійсності відбувається кон’югація зв’язків (зчеплення й усереднення), довжина утвореного зв’язку 0,141 нм. При утворенні кон’югованої системи виділяється певна порція енергії порівняно з сумою енергій простих і подвійних зв’язків, що відповідають формулам Кекуле. Ця різниця (163 кДж/моль) між ефективною сумою енергій простих (3·338,6 кДж/моль) і подвійних (3·610,3 кДж/моль) зв’язків та реальною вивіреною енергією молекул називається статичним ефектом кон’югації і характеризує стабільність молекули бензену. Чим більша енергія виділяється при утворенні такої структури, тим стабільніша сама структура, а ця стабільність визначає і хімічні властивості бензену. На прикладі бензену, його гомологів та інших груп ароматичних сполук, було зроблено узагальнення залежності ароматичних властивостей від будови молекули; це узагальнення включаєтакі умови׃
– плоска будова молекули;
– наявність в ній циклічної кон’югованої системи, яка має особливий вид зв’язку (ароматичний), довжина якого 0,141 нм;
– відповідність кількості негібридизованих р -електронів в цій системі правилу Хюкеля — N = 4n+2.


|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3413; Нарушение авторских прав?; Мы поможем в написании вашей работы!