
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування. 1. В промисловості галогеновуглеводні добувають найчастіше прямим галогенуванням насичених вуглеводнів за високої температури
|
|
|
|
1. В промисловості галогеновуглеводні добувають найчастіше прямим галогенуванням насичених вуглеводнів за високої температури, необхідної для перебігу вільнорадикальних реакцій, наприклад:

2. З синтетичних методів добування галогеновуглеводнів найбільше значення мають такі:
а) заміщення в молекулах спиртів гідроксильної групи на галоген у реакції з галогеноводнями, яка відбувається за схемою:
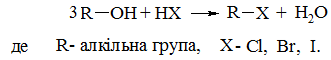
б) дією на спирти галогенідів фосфору або тіонілхлориду:
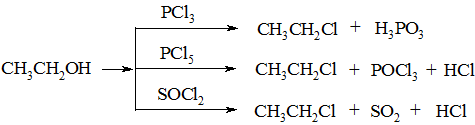
3. Приєднання галогеноводню до алкенів:

4. Бензилгалогеніди синтезують галогенуванням бічного відгалуження алкіларенів:
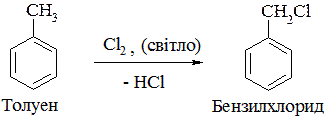
Арилгалогеніди добувають галогенуванням аренів або алкіларенів за кімнатної температури та наявності каталізаторів − галогенідів алюмінію або феруму (ІІІ):

11.4. Хімічні властивості
Алкілгалогеніди – одні з найбільш реакційноздатних органічних речовин. Більшість реакцій цих речовин відбувається за участі атома галогену, тому хімічні властивості алкілгалогенідів значною мірою визначаються поляризацією зв’язку C−Hal. Атом галогену більш електронегативний, ніж атом Карбону, тому електронна пара зв’язку C→Hal значно зміщена до атома галогену. Внаслідок цього зв'язок поляризується і атом галогену має заряд δ‾, а атом Карбону – заряд δ+. Подібний вплив на розподіл електронів у σ-зв’язках відомий як індукційний ефект. Поляризація зв’язку C→Hal передається на сусідні С–С і С–Н зв’язки і зумовлює полярність молекули. Тому для галогеновуглеводнів можливий розрив зв'язку С−Нal з відщепленням іона галогену. Це можуть бути реакції іонного нуклеофільного заміщення, в яких нуклеофіл (Nu) атакує атом Карбону і проходить заміна галогену на більш сильну основу або реакції елімінування, коли нуклеофіл атакує атом Гідрогену і відщеплює його, внаслідок чого утворюється подвійний зв'язок.
Реакція заміщення:
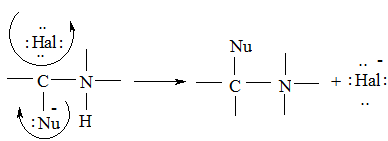
Реакція елімінування:

Природа галогену достатньо сильно впливає на реакційну здатність галогеновуглеводнів, оскільки визначає поляризацію зв’язку С−Hal, яка зменшується в ряду R−I < R−Br <R−Cl < R−F.
1. Реакції нуклеофільного заміщення атомів галогену в галогеновуглеводнях.
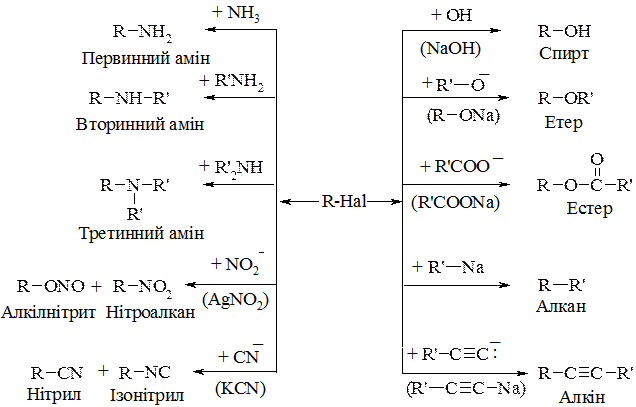
2. Реакції елімінування (відщеплення, дегідрогалогенування). При дії на галогеновуглеводні спиртового розчину лугу від них легко відщеплюються елементи галогеноводневої кислоти і утворюються ненасичені вуглеводні (відщеплення відбувається за правилом Зайцева):

3. Реакції утворення металоорганічних сполук. При дії на галогеновуглеводні металів (Li, Zn, Mg) утворюються металоорганічні сполуки (атом галогену заміщується атомом металу). Особливо важливою є реакція галогеновуглеводнів з металічним магнієм, в результаті якої утворюються змішані магнійорганічні сполуки (реактив Гріньяра):
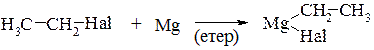
4. Реакції відновлення.

5. Реакції арилгалогенідів. На відміну від алкілгалогенідів арилгалогеніди важче вступають в реакції нуклеофільного заміщення. Проте, якщо ароматичне кільце містить, крім галогену, електроноакцепторні групи (нітрозо-, нітро-, ціано- або карбоксильну групу) в орто - або пара- положеннях до галогену, заміщення відбувається швидше. Наприклад:
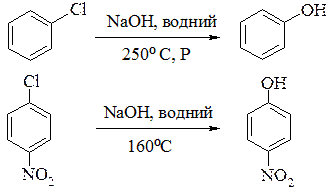
Менша рухливість галогену в арилгалогенідах пояснюється тим, що атом галогену в цих сполуках сполучений з sp2-гібридизованим атомом Карбону, який є електронегативнішим, ніж sp3-гібридизований атом Карбону насичених вуглеводнів. Внаслідок цього зв'язок C−Hal в ароматичних сполуках міцніший, ніж у зв’язках з участю sp3-гібридизованого атома Карбону.
Крім того, π-електрони подвійного зв’язку перешкоджають підходу атакуючого нуклеофілу на близьку відстань.

Меншу рухливість галогену в арилгалогенідах можна пояснити також +М-ефектом, який зменшує полярність зв’язку С−Hal і таким чином протидіє його гетеролізу:

Подібність у властивостях з арилгалогенідами виявляють вінілгалогеніди, які також не реакційноздатні по відношенню до нуклеофілів.
11.5. Окремі представники
Метилхлорид добувають у промисловості хлоруванням метану. Використовується як алкілюючий реагент в органічному синтезі.
Дихлороетан широко використовується як органічний розчинник для екстракції жирів і восків, знежирювання хутра, металевих виробів перед хромуванням та нікелюванням; при виробництві вінілхлориду, етиленгліколю тощо.
Хлороформ широко використовується як розчинник, екстрагент, а також як вихідна речовина для різних органічних синтезів. [1], c. 209-227; [2], c. 281-307.
Контрольні запитання та завдання
1. Запропонуйте схему синтезу: хлористого етилу; фтористого етилу; йодистого етилу; ізопропілброміду; хлористого бензилу.
2. Запропонуйте схеми можливих лабораторних синтезів з бензену, толуену та необхідних аліфатичних та неорганічних реагентів, наведених нижче сполук:
п- бромобензилхлориду; 1,3,5-трихлоробензену.
3. Напишіть рівняння реакцій втор- бутилброміду з такими реагентами: NaOH (водн.); КОН (спирт.); Na (мет.); Mg (етер); NН3; NaСN.
4. Розмістіть сполуки кожної групи у порядку зміни легкості дегідрогалогенування під дією концентрованого спиртового розчину КОН:
а)ізобутилбромід, трет- бутилбромід, втор- бутилбромід;
б) 2-хлоро-2-метилбутан, 1-хлоро-2,3-диметилпентан, 3-хлоропентан;
в) 2-бромо-1-фенілпропан та 3-бромо-1-фенілпропан.
5. Напишіть рівняння реакцій, за допомогою яких можна розрізнити:
а) 4-хлоро-1-бутен та н-бутилбромід; б) бромоциклогексан та бромобензен. Поясніть перебіг цих реакцій.
12. Гідроксисполуки (спирти)
12.1. Класифікація
Спирти поділяють за такими ознаками:
1. За кількістю ОН– груп у молекулі: одно-, дво-, три- і багатоатомні спирти. Наприклад:
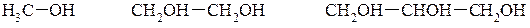
2. За будовою вуглеводневого залишку, сполученого з –ОН групою: насичені, ненасичені, циклічні, ароматичні, гетероциклічні спирти.
3. Одноатомні спирти поділяють за типом атома Карбону, з яким сполучена −ОН група: первинні, вторинні, третинні:

|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2230; Нарушение авторских прав?; Мы поможем в написании вашей работы!