
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування. 1) Історична; 2) Раціональна; 3) Систематична (IUPAC)
|
|
|
|
Номенклатура
1) Історична; 2) Раціональна; 3) Систематична (IUPAC).
За історичною (тривіальною) номенклатурою альдегіди називають за назвами відповідних кислот, в які вони перетворюються при окисненні, з додаванням у кінці назви альдегід.
За раціональною номенклатурою – як похідні оцтового альдегіду. Для назви кетонів за раціональною номенклатурою називають вуглеводневі залишки, що сполучені з карбонільною групою, та додають слово кетон.
За систематичною номенклатурою в основі назви альдегідів і кетонів лежить назва вуглеводню з таким самим числом атомів Карбону, включаючи атом Карбону карбонільної групи, а також суфікс для альдегідів – - аль, адля кетонів – - он із зазначенням номера атома Карбону, безпосередньо сполученого з атомом Оксигену. Наприклад:

1. Окиснення спиртів: первинні спирти дають альдегіди; вторинні – кетони:
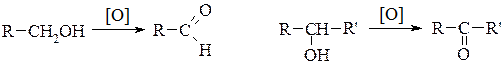
Третинні спирти окиснюються з розривом карбонового ланцюга біля атома Карбону, сполученого з −ОН групою і утворюють суміш продуктів окиснення.
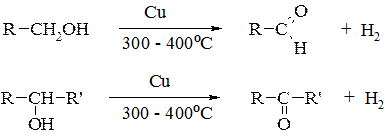
2. Дегідрування спиртів:
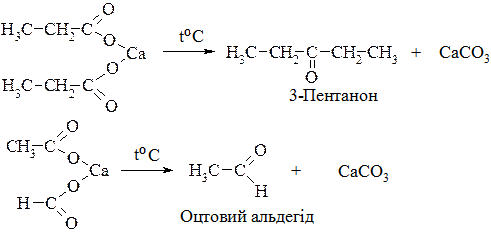
3. Суха перегонка кальцієвих або барієвих солей карбонових кислот. Кислоти можуть бути однаковими або різними. Якщо одна з кислот мурашина, утворюються альдегіди, в решті випадків – кетони.
4. Оксосинтез (пряме карбонілювання) – це важливий промисловий метод добування альдегідів:
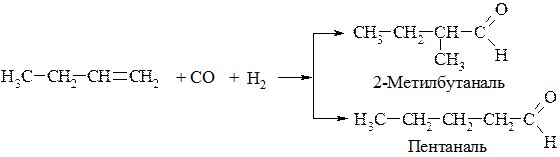
5. Гідроліз гемінальних дигалогенопохідних:
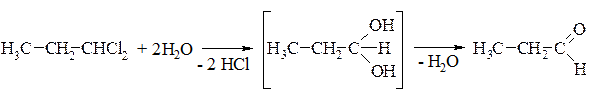

6. Гідратація ацетиленових вуглеводнів (за реакцією Кучерова) (див. алкіни).
7. Ацилювання аренів та їх похідних за Фріделем-Крафтсом:
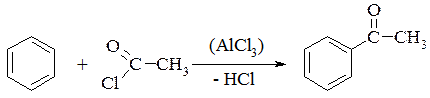
8. Ацилювання аренів та їх похідних за реакцією Гаттермана-Коха (пряме введення карбонільної групи):
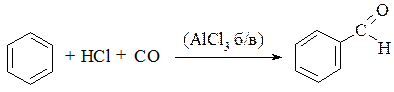
16.5. Фізичні властивості
Насичені альдегіди і кетони – це безбарвні рідини, крім метаналю, який за нормальних умов є газом. Починаючи з С16 – тверді, переважно розчинні у воді речовини. Альдегіди характеризуються більш різким запахом, ніж кетони. Оксосполуки киплять при значно нижчій температурі, ніж спирти з такою ж кількістю атомів Карбону, тому що для них наявність водневого зв’язку не характерна. Причому кетони киплять при вищий температурі, ніж альдегіди з однаковою кількістю атомів Карбону.
Ароматичні альдегіди та кетони – прозорі рідини або кристалічні речовини, часто з запахом гіркого мигдалю (альдегіди) і квітів (кетони).
16.6. Хімічні властивості
Висока активність оксосполук обумовлена наявністю в їх молекулах карбонільної групи та особливостями її будови. В карбонільній групі зв’язок між атомами Карбону та Оксигену здійснюється двома парами електронів і складається з σ- і π-зв’язків.
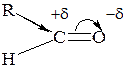
За рахунок розриву π-зв’язку ця група здатна вступати в реакції приєднання, в яких реакційна здатність підвищується за рахунок поляризації зв’язку С−О. Таким чином, для оксосполук характерні реакції приєднання по місцю розриву поляризованого С−О зв’язку (I група реакцій).
Внаслідок зміщення електронної густини в групі від Карбону до Оксигену, атом Карбону, збіднений електронною густиною, починає відтягувати її від інших сусідніх атомів, тобто від атомів Карбону, що знаходяться в α-положенні по відношенню до карбонільної групи в молекулах кетонів, а також від атома Гідрогену в молекулах альдегідів. У випадку зміщення електронної густини від Гідрогену до Карбону зв’язок С−Н послаблюється і стає високореакційноздатним в реакціях окиснення (II група реакцій), тому альдегіди окиснюються дуже легко на відміну від кетонів.
У випадку активних полярних агентів, які здатні в реакціях з карбонільною групою утворити термодинамічно стійку сполуку Н2О, в ній розщеплюються як π-зв’язок, так і σ-зв’язок. За цих умов відбуваються реакції заміщення Оксигену в карбонільній групі (III група реакцій). Іноді ці реакції називають реакціями конденсації по карбонільній групі.
Подібно до алкенів за рахунок π-зв’язку в карбонільній групі відбуваються реакції полімеризації оксосполук (IV група реакцій).
Як уже згадувалось, збіднений електронною густиною атом Карбону карбонільної групи відтягує на себе електронну густину від сусіднього
α-карбонового атома. При цьому послаблюється зв’язок між Карбоном в
α-положенні та сполученими з ним атомами Гідрогену. Це дві групи реакцій: реакції заміщення атомів Гідрогену в α-положенні (V група реакцій); реакції ущільнення карбонового ланцюга оксосполук (VI група реакцій). Останні іноді називають реакціями конденсації з участю α-карбонових атомів.
I. Реакції приєднання.
1. Взаємодія з амоніаком:
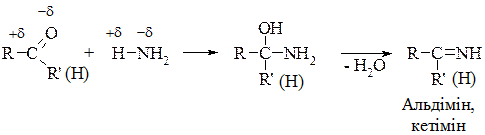
2. Взаємодія зі спиртами:
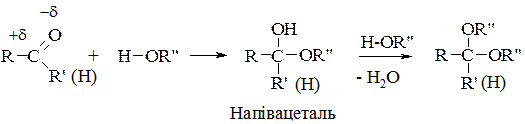
3. Взаємодія з ціановоднем (оксинітрильний синтез):
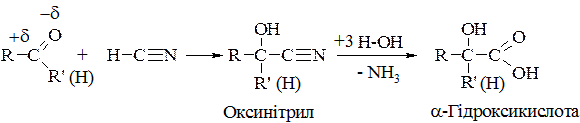
4. Приєднання натрій гідросульфіту NaHSO3 – утворення безбарвних осадів бісульфітних похідних є якісною реакцією на оксосполуки:
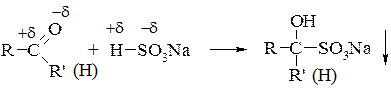
5. Приєднання магнійорганічних сполук (реактивів Гріньяра):
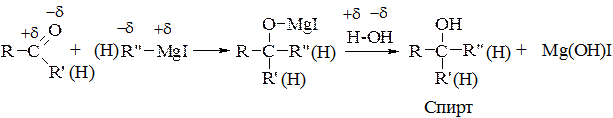
II. Реакції окиснення є якісними реакціями на альдегіди, або ж реакціями, що відрізняють альдегіди від кетонів.
1. Реакція «срібного дзеркала»:
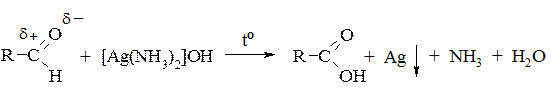
2. Реакція з фелінговою рідиною. Фелінгова рідина складається з двох компонентів (Фелінг I та Фелінг II), що змішуються безпосередньо під час досліду з альдегідом.
Фелінг I – це водний розчин СuSO4; Фелінг II – лужний розчин сегнетової солі (натрій-калій тартрат). При змішуванні Фелінгу I і Фелінгу II, по-перше, утворюється гідроксид Купруму (Сu2+):

Цей свіжеосаджений Cu(ОН)2 реагує з сегнетовою сіллю подібно до багатоатомного спирту, а саме:
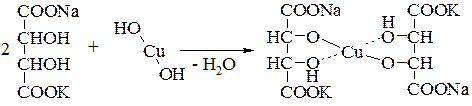
Тобто аналізований розчин набуває інтенсивно-синього забарвлення. При подальшому нагріванні відбувається окиснення альдегіду утвореним комплексом і відновлення Купруму (Сu2+) до Сu1+, а при певному співвідношенні реагентів і до металічної міді через такі сполуки:
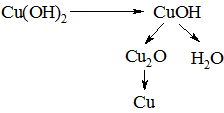
При цьому альдегід окиснюється до кислоти, випадає червоний осад Сu2О, із зруйнованого комплексу вивільняється сегнетова сіль.
3. Реакція з фуксинсульфітною кислотою – утворення малиново-червоного забарвлення у разі присутності альдегіду.
4. Кетони окиснюються в набагато жорсткіших умовах (тільки сильними окиснювачами під час нагрівання). При цьому відбувається розрив зв’язків С−С з обох боків карбонільної групи. Такий хід реакції визначається правилом Вагнера-Попова (утворюється суміш карбонових кислот).

III. Реакції заміщення.
1. Заміщення карбонільного Оксигену на 2 атоми галогена.
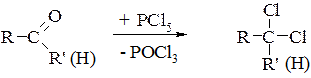
2. Взаємодія з гідроксиламіном (якісна реакція на оксогрупу):
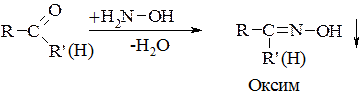
3. Взаємодія з гідразином – ще одна якісна реакція на оксогрупу, в результаті якої утворюється осад гідразону:
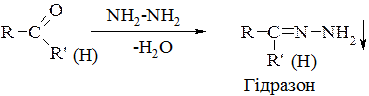
4. Найкращою якісною реакцією на оксогрупу є реакція утворення фенілгідразонів при взаємодії з фенілгідразином:
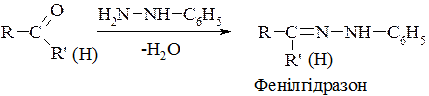
Фенілгідразони різних альдегідів і кетонів мають чітко визначені температури плавлення. Ці температури визначені та наведені в довідниках. Тому за точкою плавлення можна визначити конкретну формулу альдегідів та кетонів.
IV. Реакції полімеризації.
Характерні лише для альдегідів, в першу чергу для формальдегіду.
При ступінчатій полімеризації мурашиний альдегід утворює полімерні ланцюги з кількох атомів Карбону за схемою:
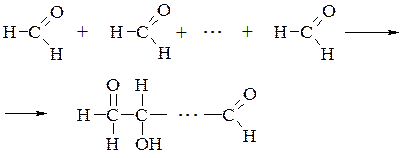
Реакції поліконденсації засновані на підвищеній реакційній здатності атомів Гідрогену в α- положенні відносно карбонільної групи. Здебільшого такі реакції проходять у присутності основних або кислотних каталізаторів (альдольно-кротонова конденсація):.
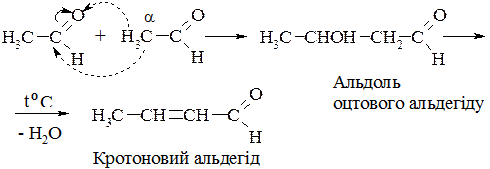
Ароматичні альдегіди та альдегіди жирного ряду, що не мають Гідрогену в α- положенні, вступають в реакцію диспропорціювання або реакцію Канніццаро:
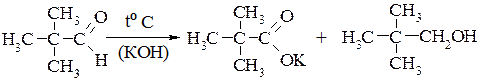
Для альдегідів, які містять атоми Гідрогену в α- положенні, можлива естерова конденсація Тищенка:
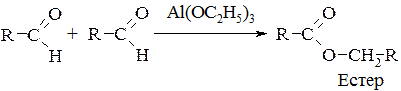
Для переходу від оксосполук до алканів використовується реакція Кіжнера-Вольфа:
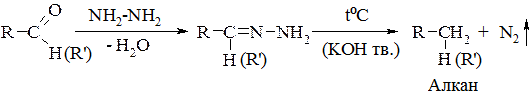
16.7. Окремі представники
Мурашиний альдегід (формальдегід) – прозорий газ з різким запахом, отруйний. Його 40%-ий водний розчин широко використовується для синтезу високомолекулярних сполук (смоли, пластмаси, волокна), в органічному синтезі, для дезинфекції. На основі формальдегіду у великій кількості отримують уротропін, який застосовується у виробництві пластичних мас, вибухівки, ліків.
Оцтовий альдегід – рідина з різким запахом, виробляється у великих кількостях для одержання оцтової кислоти, етанолу, дивінілу, етилацетату, оцтового ангідриду тощо.
Ацетон – прозора рідина, ефективний розчинник для багатьох органічних сполук. Широко використовується у виробництві ацетатного шовку, пороху, фото- і кіноплівки, органічного скла тощо. [1], c. 276-299; [2], c. 361-388.
Контрольні запитання та завдання
1. Які методи можна використати для добування: ізомасляного альдегіду;
метил- втор- бутилкетону; бензальдегіду. Напишіть рівняння відповідних реакцій.
2. Напишіть рівняння реакцій та назви всіх органічних речовин, які утворюються внаслідок взаємодії пропаналю з наведеними нижче реагентами (чи з усіма реагентами він реагуватиме?): CrO2/H2SO4; холодний розбавлений KMnO4; KMnO4, H+, нагрівання; H2, Ni; втор -бутилмагнійбромід, потім H2O; NaHSO3; НCN, H+; гідроксиламін; фенілгідразин, етанол, сухий HCl (газ); NaOH (розб.); HCl (розб.); Na2CO3 (водн.); Br2.
3. Напишіть рівняння реакцій та назвіть усі органічні сполуки, які утворюються внаслідок взаємодії метилізопропілкетону з реактивами завдання 2 (чи з усіма реагентами він реагуватиме?)
4. Напишіть рівняння реакцій та назвіть усі органічні сполуки, які утворюються внаслідок взаємодії бензальдегіду з наведеними нижче реагентами (чи з усіма реагентами він реагуватиме?): NaOH (конц.); NaOH (розб.); формальдегід; НCN, H+;
трет -бутилмагнійіодид, з подальшим гідролізом; ацетон; етилацетат.
5. Напишіть рівняння реакцій для всіх стадій синтезу наведених нижче сполук з пропаналю, використовуючи відповідні реагенти: а) н -пропанол; б) пропанова кислота;
в) втор -бутиловий спирт; г) метилетилкетон; д) 2-метил-3-пентанол; е) 2-метил-1-пентанол; є) 2-метил-2-пентен-1-ол; ж) 2-метил-1,3-пентандіол.
6. Напишіть рівняння реакцій для всіх стадій синтезу наведених нижче сполук з ацетофенону, використовуючи необхідні реагенти: етилбензен; бензенова кислота;
2-феніл-2-бутанол; 2-феніл-2,3-пентандіол.
17. Карбонові кислоти
Карбонові кислоти – це похідні вуглеводнів, які містить у молекулі одну або кілька карбоксильних груп.
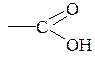
Кількість карбоксильних груп у молекулі карбонової кислоти визначає основність кислоти: кислоти з однією карбоксильною групою є одноосновними, з двома – двоосновними і т.д.
Залежно від природи радикалу (алкільного залишку), сполученого з карбоксильною групою, карбонові кислоти поділяють на насичені і ненасичені. За кількістю атомів Карбону у радикалі розрізняють кислоти: нижчі (низькомолекулярні) і вищі (високомолекулярні).
17.1. Одноосновні карбонові кислоти
Насичені одноосновні карбонові кислоти мають загальну формулу:
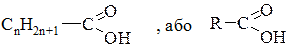
де R – відповідний вуглеводневий радикал або атом Гідрогену (Н).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 5174; Нарушение авторских прав?; Мы поможем в написании вашей работы!