
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура. 1. Тривіальна номенклатура:
|
|
|
|
1. Тривіальна номенклатура:

2. За замісниковою (залишково-функціональною) номенклатурою − спирти називають відповідно назві вуглеводневого залишку, з яким сполучена гідроксильна група, наприклад:

3. За раціональною номенклатурою будь-який спирт розглядається як продукт заміщення одного або кількох атомів Гідрогену на вуглеводневі залишки в радикалі найпростішого спирту − метилового СН3ОН, який має назву карбінол. Наприклад:

4. За систематичною (IUPAC) номенклатурою назва спирту утворюється від назви відповідного алкану додаванням до неї закінчення - ол з позначенням номера атома Карбону, біля якого вона розміщена, причому останній обов’язково повинен бути у складі основного ланцюга, а нумерація карбонового ланцюга починається з того кінця, до якого ближче розміщена функціональна група −ОН. Наприклад:
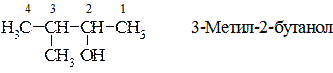
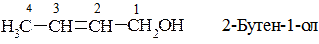
Дво-, три- і т.д. основні спирти за систематичною номенклатурою IUPAC називають відповідно до існуючих правил, додаючи до назви алкану закінчення - діол,-тріол і т.д. Наприклад:
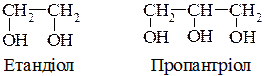
12.3. Ізомерія
В ряду насичених одноатомних спиртів можлива: а) ізомерія карбонового скелета вуглеводневого залишку; б) ізомерія положення гідроксильної групи в однакових ланцюгах; в) конформаційна ізомерія.
Для ненасичених спиртів існує цис-, транс -ізомерія. Наприклад:

12.4. Фізичні властивості
На властивості спиртів дуже сильно впливає здатність їх молекул утворювати водневі зв’язки між собою, а також з іншими полярними молекулами:
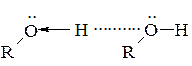
За рахунок водневого зв'язку між рухливими атомами Гідрогену гідроксильних груп одних молекул і вільних електронних пар атомів Оксигену сусідніх молекул відбувається асоціація молекул спиртів. Внаслідок цього ущільнюється упаковка молекул і нижчі спирти (С1−С10) мають вищі температури кипіння, ніж ізомерні їм етери, наприклад:

Починаючи з С11 спирти – мастильні або тверді тіла. Густина всіх спиртів менша за одиницю.
За рахунок утворення водневих зв’язків між молекулами спирту і води (для нижчих гомологів) відбувається необмежена взаємна розчинність спиртів у воді:
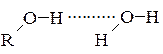
Для вищих гомологів розчинність у воді набагато погіршується за рахунок того, що в молекулах таких спиртів відносно велику частку займає вуглеводневий залишок, який розчинний у неводних розчинниках.
Насичені спирти незабарвлені. Запах нижчих спиртів – характерний різкий «алкогольний», середніх гомологів – сильний неприємний «сивушний»; третинні спирти мають характерний запах плісняви; вищі спирти – позбавлені запаху.
Температура кипіння спиртів залежить від їх будови: у первинних спиртів вона вища, ніж у вторинних, які у свою чергу, характеризуються більшою температурою кипіння порівняно з третинними.
12.5. Методи добування одноатомних спиртів
1. Окиснення алканів (метод має практичне застосування для промислового добування вищих насичених спиртів):
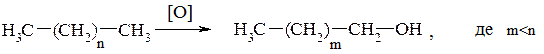
2. Лужний гідроліз моногалогенопохідних вуглеводнів (заміщення Hal на −ОН групу під дією водного розчину лугу):

Цим методом добувають як первинні, так і вторинні та третинні спирти.
3. Гідратація алкенів (див. реакції алкенів):
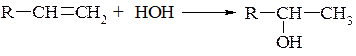
4. Добування з оксосполук.
а) відновлення оксосполук та естерів:
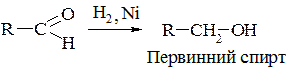
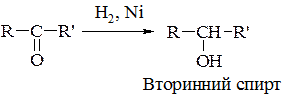
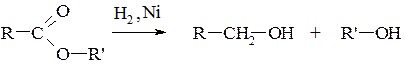
(третинні спирти відновленням добути неможливо).
5. Синтези за допомогою металоорганічних сполук (застосування реактивів Гріньяра). Ці сполуки легко приєднуються до полярних кратних зв’язків таким чином, що алкіл приєднується до атома Карбону, а інша частина – до атома Оксигену:
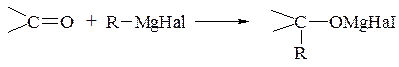
При подальшому розщепленні утворених сполук водою добувають спирти різної будови. Так, з мурашиного альдегіду (реакція Тищенка) отримують первинні спирти:
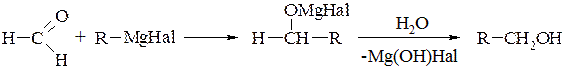
З інших альдегідів утворюються вторинні спирти (реакція Вагнера):
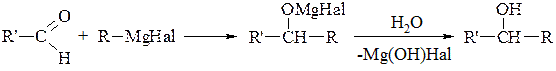
З кетонів завжди утворюються третинні спирти (реакція Зайцева):
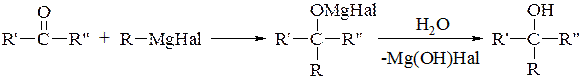
6. Гідроліз естерів − застосовується для промислового добування високомолекулярних спиртів із восків:
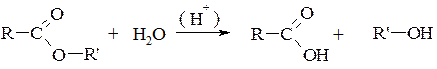
7. Оксосинтез – при карбонілюванні алкенів утворюються альдегіди, які потім відновлюють до спиртів:

8. Бродіння вуглеводів (ферментативне) широко застосовують для добування етилового спирту:
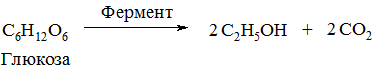
12.6. Хімічні властивості спиртів
Спирти вступають у реакції двох основних напрямків:
1. З розривом зв’язку О−Н.
2. З розривом зв’язку С−О.
Реакції з розривом зв’язку О−Н характеризують кислотні властивості спиртів. В гідроксильній групі електронна густина зміщена до більш електронегативного атома Оксигену. Поляризація зв’язку О−Н полегшує відщеплення атома Гідрогену у вигляді протона, тобто призводить до виявлення спиртами кислотних властивостей. Цей атом Гідрогену здатний замінюватись на атом металу (М) при взаємодії з лужними металами:

Утворені алкоголяти можна розглядати, як солі сильних основ і слабких кислот (якими є спирти). Тому у водних розчинах вони легко гідролізують, зумовлюючи лужну реакцію середовища:

До другої групи реакцій спиртів (реакції заміщення спиртового гідроксилу – реакції з розривом С−О зв’язку) відносяться такі, як заміщення гідроксильної групи на атоми галогенів. Реакція відбувається при дії на спирти як газоподібних галогеноводнів або їх водних розчинів, так і галогенангідридів неорганічних кислот PCl5, PBr3, SOCl2 тощо.
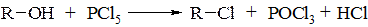
У ряді випадків спирти можуть реагувати як з розривом С−О зв’язку, так і з розривом С−Н зв'язку:
1. Реакція етерифікації – утворення етерів (простих ефірів) внаслідок міжмолекулярної дегідратації спиртів:
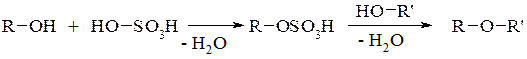
2. При внутрішньомолекулярній дегідратації із спиртів отримують алкени (у відповідності до правила Зайцева):
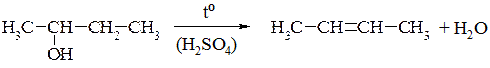
3. Естерифікація – утворення складних ефірів (естерів) при взаємодії спиртів з органічними кислотами:
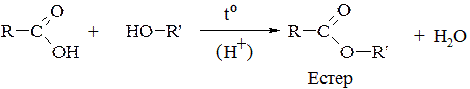
4. Окиснення спиртів – залежно від будови спирту та застосованого окисника (KMnO4, K2Сr2O7, CrO3 або О2 у присутності міді) спирти окиснюються до альдегідів, кетонів або карбонових кислот.
Первинні спирти утворюють альдегіди, які далі окиснюються до відповідних кислот:
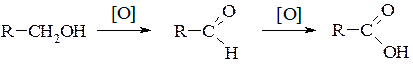
Із вторинних спиртів утворюються кетони:
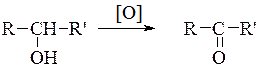
Третинні спирти окиснюються важко з розривом карбонового ланцюга.
12.7. Окремі представники
Метанол СН3ОН – метиловий спирт, деревинний спирт. Дуже токсичний; використовується лише для технічних потреб в якості розчинника лаків і палітур, як сировина для видобування формальдегіду, органічних барвників та ін.
Етанол С2Н5ОН – етиловий спирт, винний спирт. За обсягом виробництва етанол посідає одне з перших місць серед продукції хімічної промисловості. Найпоширеніший метод добування етанолу для харчової та фармацевтичної промисловості – бродіння цукристих речовин. Застосовується майже в усіх галузях народного господарства: для добування синтетичного каучуку, виготовлення лаків і оліф, барвників, як розчинник, для виготовлення спиртних напоїв, фармацевтичних препаратів тощо. [1], c. 228-246; [2], c. 309-326.
13. Багатоатомні спирти
Для добування можуть бути застосовані ті самі методи, що і для одноатомних спиртів, але вихідними сполуками є біфункціональні похідні. Найбільший інтерес мають спеціальні методи добування цих сполук:
1. Гідроксилювання алкенів (реакцією Вагнера):
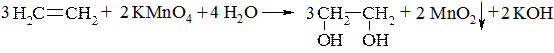
2. Гідроліз оксиранів (промисловий метод):

3. Добування гліцерину з пропілену (промисловий метод):
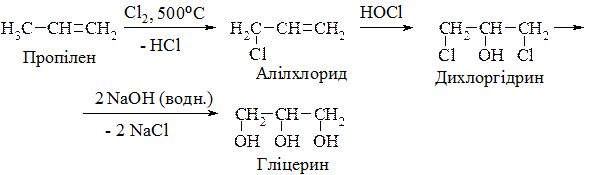
4. Гідроліз жирів (естерів вищих карбонових кислот і гліцерину):
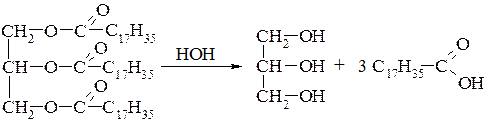
13.1. Хімічні властивості
Багатоатомні спирти можуть виявляти всі властивості одноатомних спиртів, причому в реакції може брати участь одна або кілька гідроксильних груп (реакції відбуваються постадійно).
Найбільший інтерес становлять специфічні реакції багатоатомних спиртів, зумовлені наявністю в молекулі кількох –ОН груп, їх взаємним впливом та взаємодією.
1. Багатоатомні спирти з α-розміщеними гідроксильними групами здатні реагувати з гідроксидами важких металів з утворенням комплексних сполук:
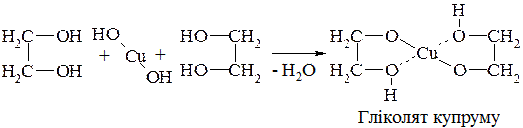
2. Дегідратація етиленгліколю за Фаворським приводить до утворення циклічного етеру − діоксану:
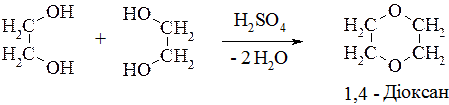
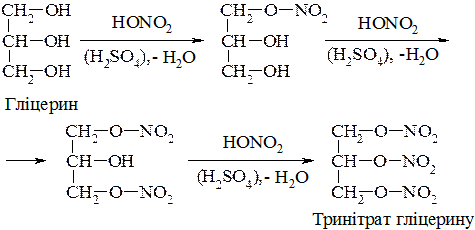
3. Дегідратація гліцерину в присутності водовіднімних засобів (KHSO4, MgSO4, H3BO3) або сульфатної кислоти приводить до утворення акролеїну:
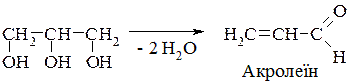
13.2. Окремі представники
1,2−Етандіол (етиленгліколь) – безбарвна густа і дуже токсична рідина без запаху, що застосовується як пластифікатор у виробництві синтетичних волокон (лавсан); для добування діоксану – важливого лабораторного розчинника. Крім того, його застосовують як антифриз для охолодження автомобільних двигунів.
Діетиленгліколь, триетиленгліколь та інші поліетиленгліколі застосовуються в харчовій, фармацевтичній промисловості та у виробництві косметичних засобів як зволожувачі та емульгатори.
Гліцерин – густа сиропоподібна рідина, солодка на смак. Гліцерин широко використовується в парфумерії, харчовій промисловості, для отримання вибухівки (тринітрату гліцерину), в шкірообробній та паперовій промисловості; для синтезу алкідних та епоксидних смол тощо. [1], c. 247-256; [2], c. 329-339.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1299; Нарушение авторских прав?; Мы поможем в написании вашей работы!