
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомологи бензену
|
|
|
|
Гомологи бензену – це похідні, утворені в результаті заміни атомів Гідрогену ядра на алкільні залишки:

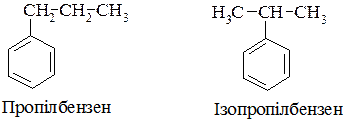
10.2.3. Ізомерія та номенклатура.
Ізомерія в ряду гомологів бензену зумовлена як структурними відмінностями будь-якого бічного відгалуження (наприклад ізопропілбензен та пропілбензен), так і взаємним розташуванням замісників у ядрі (наприклад: орто -, мета -, та пара -положення).

Розрізняють три види номенклатур: тривіальна, раціональна, систематична. За систематичною IUPAC номенклатурою нумерація замісників у ядрі змінюється в порядку старшості і в такому напрямку, щоб замісники, що є в бензеновому кільці, набули найменші номери (правило локантів).
Залишки похідних аренів матимуть такі назви:
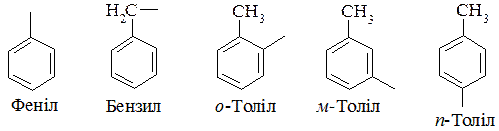

10.2.4. Методи добування бензену та його гомологів.
1. У промислових масштабах бензен та його гомологи виділяють із нафти, збагаченої аренами, шляхом простої перегонки; із нафти, збагаченої аліфатичними вуглеводнями, – шляхом ароматизації, риформінгу, платформінгу та іншими способами.
2. Синтез бензену із ацетилену (М. Зелінський, Казанський):

3. Дегідрування циклогексану:
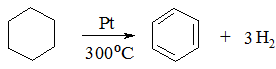
4. Гомологи бензену можна синтезувати за реакцією Вюрца-Фіттіга, (1864р.) – взаємодією суміші ароматичних та аліфатичних галогенопохідних з натрієм:
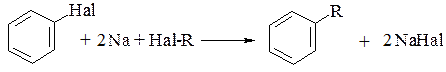
5. Реакція Фріделя-Крафтса (1871 р.) – полягає у дії аліфатичних галогенопохідних на бензен у присутності каталізаторів – галогенідів перехідних металів (AlCl3, FeBr3, CrI3, SnCl4, ZnCl2 безводні):
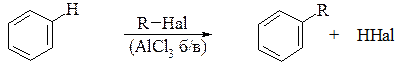
6. Алкілювання бензенуалкенами:
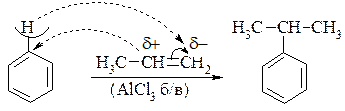
10.2.5. Хімічні властивості
Як уже згадувалося, по-перше, молекула бензену (або взагалі ароматичне ядро) стабілізовані кон’югацією, а це означає, що бензен не вступає практично в реакції, які порушують кон’югацію. Арени не знебарвлюють бромну воду та розчин калійперманганату, вони дуже неохоче і лише в специфічних умовах вступають в реакції приєднання.
І. Реакції приєднання.
1. Приєднання водню (реакція гідрування). При дії Гідрогену за наявності каталізатора (Pt, Pd, Ni) і тиску при температурі 110°С утворюється циклогексан:
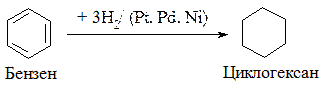
2. Приєднання галогенів. На сонячному світлі під дією ультрафіолетового проміння відбувається швидке приєднання трьох молекул хлору з утворенням гексахлороциклогексану (гексахлорану):

Реакції приєднання не характерні для аренів.
ІІ. Реакції електрофільного заміщення.
Оскільки кільце з обох боків площини оточене електронами π–зв’язків, то до такого утворення будуть охоче притягатися позитивно заряджені частинки, які заміщують атоми Гідрогену в ядрі (які в свою чергу відщепляються у вигляді протонів). Таким чином, найхарактернішими є реакції заміщення атомів Гідрогену в ядрі на інші атоми або групи. Зважаючи на позитивний заряд цих замісників, заміщення є електрофільним. Цей тип реакції позначається символом SЕ (substitution electrophylic).
1. Реакція галогенування:
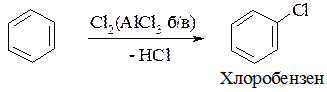
2. Реакція нітрування:
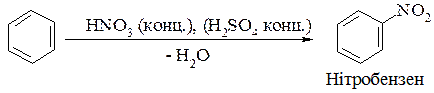
3. Реакція сульфування:
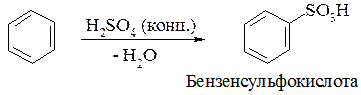
4. Реакція алкілювання за Фріделем-Крафтсом:
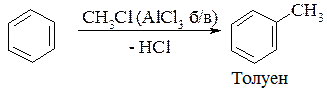
5. Реакція ацилювання:
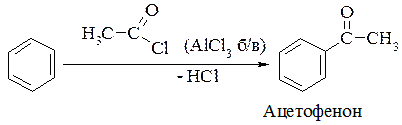
В усіх реакціях заміщення бере участь електрофільний реагент (–Сl+,
–NO2+, –SO3H+) (електрофіл з грецької – той, що любить електрони).
Механізм реакції електрофільного заміщення:

Вплив замісників в атомному ядрі на напрямок заміщення атомів Гідрогену в реакціях (SЕ) електрофільного заміщення.
У незаміщеному бензеновому ядрі всі атоми Карбону однакові за своєю хімічною природою.
При введені в бензеновий цикл замісника йде перерозподіл електронної хмари і реакційна здатність атомів Карбону стає неоднаковою, вона залежить від замісника. Кожен замісник у бензеновому ядрі має певну орієнтуючу дію. За дією спрямування їх поділяють на замісники (орієнтанти) першого (І) і другого (ІІ) роду.
Орієнтанти першого роду (І) в порядку спадання орієнтуючоїактивності розташовані в ряду:
–NR2 > –NHR > –NH2 > –OR > –OH > –CH3 > –Alk > –Cl > –Br > –I.
Ряд замісників ІІ роду за зменшенням орієнтуючої сили:
–NO2 > –CN > –SO3H >  >
> 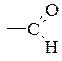 >
> 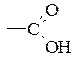 .
.
1. Замісники І роду спрямовують новий електрофільний замісник в орто -, або в пара -положення.
2. Замісники ІІ роду орієнтують новий замісник у мета -положення.
3. При наявності в бензеновому ядрі двох замісників одного і того ж роду, орієнтуючу діяльність проводить більш сильніший замісник (згідно рядів).
4. При наявності в бензеновому ядрі двох замісників різного роду орієнтуючий вплив проводить замісник І роду.
З погляду електронних уявлень орієнтуючий вплив замісників пояснюють так:
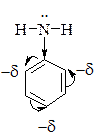
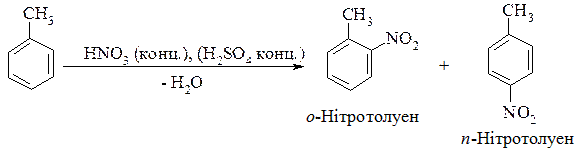
Орієнтанти (замісники) І роду, наприклад, у молекулі аніліну – це електронодонорна аміногрупа, яка за позитивним мезомерним ефектом (+М) віддає електронну густину ядру, яке при цьму збагачується електронною густиною, що полегшує перебіг реакції SЕ, особливо в орто- і пара- положеннях відносно замісника першого роду, куди і спрямовуються електрофіли (позитивно заряджені частинки). Наприклад, для толуену (СН3 замісник першого роду):
Атоми галогенів, на відміну від інших замісників першого роду, мають яскраво виражений негативний індукційний ефект (–I), проте, вони спряжені з бензеновим ядром і виявляють позитивний мезомерний ефект (+М), тому спрямовують електрофіли в орто - та пара -положення, але на відміну від інших замісників І роду не полегшують перебіг реакції електрофільного заміщення.

Орієнтанти (замісники) ІІ роду, наприклад, у молекулі нітробензену – це нітрогрупа електронно-акцепторного характеру, що відтягує на себе електронну густину з ядра, внаслідок чого ядро збіднюється електронною густиною, що утруднює перебіг реакцій SЕ. В найбільшій мірі електронна густина відтягується від орто - та пара -положень, тому електрофіли прямують до мета -положення менш збідненого електронною густиною.
Узгоджена та неузгоджена орієнтація в ароматичному ядрі. Якщо в ядрі є два або більше замісників і вони спрямовують електрофіл в одну і ту ж саму вершину, то орієнтація узгоджена.
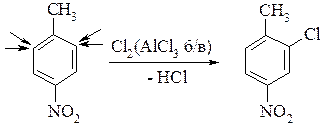
У протилежному випадку, коли замісники спрямовують електрофіл у різні вершини, то орієнтація неузгоджена.
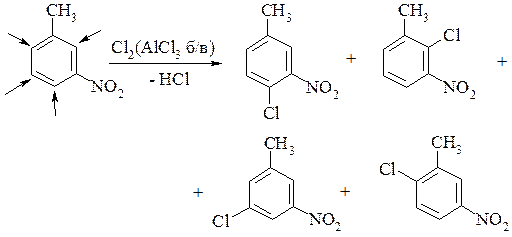
ІІІ. Реакції окиснення. 1. Бензен більш стійкий до дії окиснювачів, ніж насичені вуглеводні. Він не окиснюється розбавленою нітратною кислотою або калійперманганотом. При дії кисню повітря за наявності каталізатора V2O5 бензен окиснюється з руйнуванням циклу:
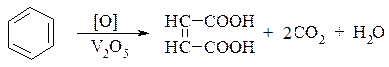
Малеїнова кислота
2. Гомологи бензену окиснюються значно легше і завжди до бензенової кислоти, незалежно від довжини і розгалуженості бічного ланцюга:
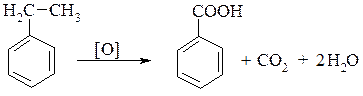
3.Озонування:
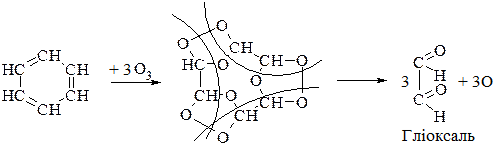
10.2.6. Окремі представники
Бензен – безбарвна рідина з характерним запахом. Його виділяють із газів під час коксування разом з ізомерними ксилолами. Це отруйна речовина.
Бензен є вихідною сполукою для синтезу багатьох інсектицидів, барвників та лікарських препаратів. Раніше він широко використовувався як розчинник і екстрагент, однак у наш час втратив своє значення через вогненебезпечність та токсичність.
Толуен добувають як і бензен з коксового газу. Використовується як розчинник, добавка до моторного палива, є вихідною сполукою для синтезу нітропохідних толуену, бензенової кислоти, сахарину. Менш отруйний, ніж бензен.
Ксилени. Технічне значення мають о - та п- ксилени, які окиснюються відповідно до о- фталевої та терефталевої кислот. Остання використовується в синтезі поліестерних полімерів.
Етилбензен. Добувають алкілюванням бензену етиленом за наявності алюміній хлориду. Використовують для синтезу стирену.
Ізопропілбензен. Добувають із бензену, алкілюючи його пропеном.
Використовують у промисловості для синтезу фенолу та ацетону.
Стирен, С6Н5–СН=СН2 – найпростіший представник ароматичних вуглеводнів, у бічному ланцюгу якого є ненасичений зв'язок. Рідина з приємним ароматом (запах квітів). Добувають стирен у великих кількостях різними методами:
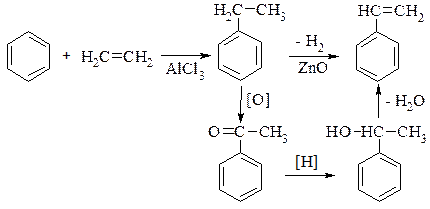 .
.
Стирен дуже легко полімеризується у склоподібний полімер – полістирен. (М. м. від 20000 – 30000). Застосовується як ізоляційний матеріал.
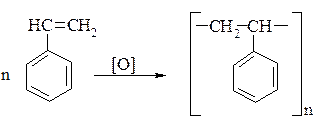
Стирен використовують також для співполімеризації з бутадієном при добуванні деяких видів синтетичних каучуків.
10.3. Багатоядерні ароматичні вуглеводні
Багатоядерними ароматичними вуглеводнями називають такі вуглеводні, молекули яких складаються з двох або більшої кількості бензенових ядер.
Розрізняють багатоядерні вуглеводні з неконденсованими бензеновими ядрами (ядра не мають спільних атомів Карбону) і з конденсованими бензеновими ядрами (ядра мають спільні атоми Карбону).
10.3.1. Багатоядерні ароматичні вуглеводні з неконденсованими бензеновими ядрами
Вони в свою чергу поділяються на вуглеводні з безпосередньо зв’язаними ядрами (група дифенілу) і вуглеводні з бензеновими ядрами зв’язаними через атоми Карбону, що не входять до циклу (дифенілметан, трифенілметан, дифенілетан).
1. Група дифенілу.
Дифеніл містить два безпосередньо зв’язаних одне з одним ядер бензену. Міститься в кам’яновугільній смолі.
 , С6Н5–С6Н5
, С6Н5–С6Н5
2,6,2',6' – орто -, 3,5,3',5' – мета -, 4,4'– пара -положення.
Добування дифенілу: 1. У промисловості дифеніл добувають піролізом бензену (пропусканням парів бензену через розплавлений свинець):
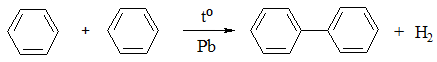
1. За реакцією Вюрца-Фіттіга із іодобензену:
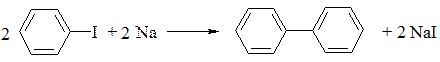
Дифеніл – кристалічна речовина з Тпл 70°С, Ткип 254°С, термічно стійкий. У хімічному відношенні веде себе аналогічно бензену, застосовується як теплоносій у різних теплообмінних апаратах (парових котлах, реакторах).
Важливим похідним дифенілу є бензидин. У промисловості його добувають з нітробензену через гідразобензен ізомеризацією останнього під впливом кислот за Зініним (бензидинове перегрупування)
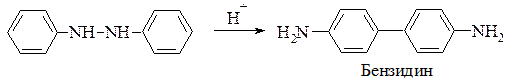
2. Дифенілметан.
Дифенілметан
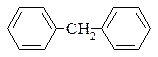 – кристалічна речовина із запахом апельсинів, з Тпл 26°С, Ткип 262°С, застосовується в парфумерії.
– кристалічна речовина із запахом апельсинів, з Тпл 26°С, Ткип 262°С, застосовується в парфумерії.
3. Група трифенілметану.
Можна розглядати як похідні метану
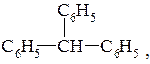

Добувають трифенілметан та його похідні:
1. Методом Фріделя-Крафтса:
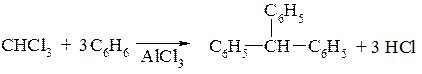
2. Конденсацією ароматичних альдегідів з фенолами і третинними ароматичними амінами:
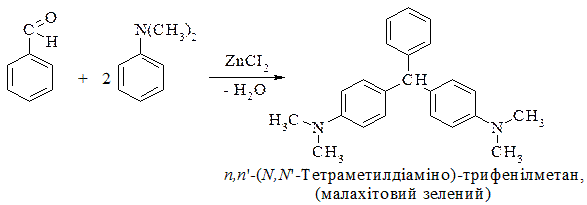
Трифенілметан– тверда сполука, відзначається великою стійкістю кільця, при взаємодії з хлором утворює трифенілхлорометан, при окисненні утворює трифенілкарбінол (спирт):

Ці взаємні перетворення відіграють велике значення в хімії. Трифенілметан є основою трифенілметанових барвників.
10.3.2. Багатоядерні ароматичні сполуки з конденсованими ядрами
Найпростішим представником класу є нафтален, С10Н8. його склад вперше встановив О.А.Воскресенський.
Будова нафталену
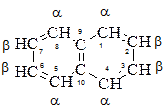
1, 4, 5, 8 — α-положення; 2, 3, 6, 7 — β-положення. За даними рентгеноструктурного аналізу має плоску будову, як і бензен, але міжатомні відстані С–С в молекулі нафталену нерівноцінні і становлять від 1,36 до 1,46 нм.
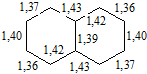
Наявність двох кілець у молекулі нафталену можна довести за допомогою реакції окиснення:
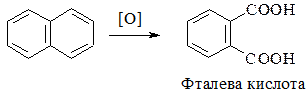
Фізичні властивості. Нафтален – тверда кристалічна речовина з характерним запахом, Тпл 80°С. Він легко сублімується. У воді не розчиняється, добре розчиняється в органічних розчинниках.
Хімічні властивості. Нафтален проявляє властивості ароматичних вуглеводнів. Для нього характерні реакції заміщення. Він вступає в реакції приєднання тільки за певних умов. Ароматичність бензенових кілець нафталену дещо нерівномірна для кожного з атомів Карбону, тому він вступає в реакції легше ніж бензен.
1. Окиснення:
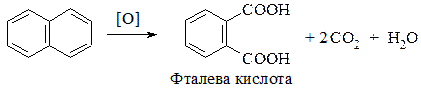
2. Галогенування:
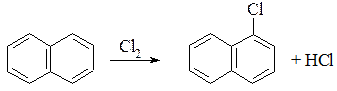
3. Нітрування:
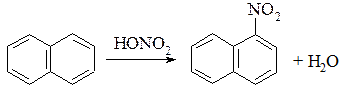
За надлишку нітратної кислоти можливо ввести і другу нітрогрупу в положення 1,5- або 1,8- — так одержують динітронафтален.
4. Сульфування:
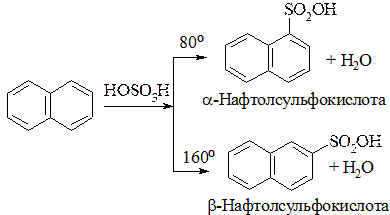
5. Реакція приєднання водню, (реакція проходить легше ніж для бензену):

Тетралін – безбарвна рідина Ткип 207°С, хороший розчинник смол, жирів, використовується для виготовлення лаків. Такі ж самі властивості і для декаліну.
Антрацен і фенантрен.
Молекулярна формула для них С14Н10, вони є ізомерами.
Містяться у кам’яновугільній смолі, виділяють їх з фракцій антраценового масла.
Антрацен – кристалічна речовина, добре розчиняється в гарячому бензені, погано – в спирті, етері, не розчиняється у воді.
У молекулі антрацену особливо рухливими є атоми Гідрогену в положенні 9 і 10 (так звані мезоположення). При дії окиснювачів (нітратна кислота, хромова суміш) вони окиснюються значно легше з утворенням антрахінону, в молекулі якого є дві кетонні групи:
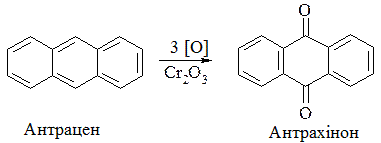
Антрахінон — кристалічна речовина жовтого кольору.
Важливими похідними антрацену є такі:


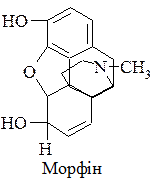
Антрагідрохінон – проміжний продукт під час відновлення антрахінону до антрацену і являє собою кристалічну речовину коричневого кольору.
Алізарин – відомий з давніх часів барвник червоного кольору. Добували його раніше з коріння рослин крапу, або марени. Тепер його синтезують.
Фенантрен – тверда кристалічна речовина Тпл 100°С, розчинна в бензені. Фенантрен не знайшов такого широкого технічного застосування як антрацен. Однак значення його досить велике.
Гідроване ядро фенантрену лежить в основі таких алкалоїдів, як морфін, кодеїн. Ядро повністю гідрованого фенантрену, конденсоване з п’ятичленним ядром циклопентану, називається пергідроциклопентанофенантреном, 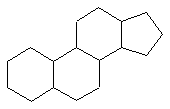 .
.
Скелет цієї сполуки лежить в основі будови молекул стероїдів, до яких належать вітамін групи Д, жовчні кислоти, статеві гормони і ряд інших дуже важливих біологічно активних речовин.
Інші багатоядерні ароматичні вуглеводні.
Крім нафталіну антрацену і фенантрену, у кам’яновугільній смолі містяться багато інших вуглеводнів з конденсованими циклами: пірен, хризен та ін.
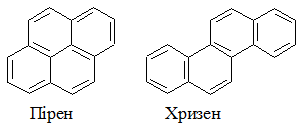
Вони є похідними фенантрену.
Велика кількість ароматичних вуглеводнів з конденсованими ядрами – канцерогенні речовини (лат. cancer – рак). Прикладом можуть бути бензпірен та дибензантрацен, які містяться в кам’яновугільній смолі і сажі.

[1], c. 185-206; [2], c. 595-657, с.742-770.
Контрольні запитання та завдання
1. Напишіть структурні формули ізомерів гомологів бензену з молекулярною формулою С9Н12. Укажіть їх назви.
2. Напишіть структурні формули і назвіть усі основні продукти, що можуть утворитися під час монобромування в кільце наведених нижче сполук. Зазначте у кожному випадку, чи буде ця сполука бромуватися швидше або повільніше, ніж бензен:
а) іодобензен; б) втор- бутилбензен; в) ацетофенон С6Н5СОСН3;
г) фенетол С6Н5ОС2Н5; д) дифенілметан; е) бензонітрил С6Н5СN;
є) біфеніл С6Н5С6Н5.
3. Розмістіть наведені нижче сполуки у порядку зменшення їх реакційної здатності у реакції нітрування (у кожному випадку окремо а), б) і т.д.):
а) бензен, толуен, м -ксилен, п- ксилен;
б) бензен, бромобензен, нітробензен, толуен;
в) хлоробензен, п- хлоронітробензен, 2,4-динітрохлоробензен;
г) 2,4-динітрохлоробензен; 2,4-динітротолуен;
д) м- динітробензен, 2,4-динітротолуен.
4. Укажіть усі стадії лабораторного синтезу наведених нижче сполук із бензену, використовуючи будь-які необхідні аліфатичні або неорганічні реагенти:
а) п- нітротолуен; б) п- бромонітробензен; в) п- дихлоробензен;
г) м- бромобензенсульфокислота; д) п- бромобензенсульфокислота; е) п- бромобензенова кислота; є) м- бромобензенова кислота; ж) 1,3,5-тринітробензен; з) 2-бромо-4-нітротолуен; и) 2-бромо-4-нітробензенова кислота; і) 3,5-динітробензенова кислота;
к) 4-нітро-1,2-дибромобензен; л) 2-нітро-1,4-дихлоробензен; м) 4-бромо-3-нітробензенова кислота.
5. Укажіть усі стадії лабораторного синтезу наведених нижче сполук, використовуючи необхідні аліфатичні або неорганічні реагенти: 4-нітро-2,6-диброманізену з анізолу С6Н5ОСН3; 4-бромо-2-нітробензенової кислоти з о-нітротолуену; 2,4,6-трибромоаніліну з аніліну; 2,4-динітроацетаніліду з ацетаніліду С6Н5NHОСН3; 5-нітроізофталевої кислоти з
м- ксилену; 4-нітроізофталевої кислоти; з м- ксилену; 2-нітротерефталевої кислоти з
п- ксилену.
6. Запропонуйте схеми синтезу наведених нижче сполук із бензену та (або) толуену, використовуючи необхідні аліфатичні та неорганічні реагенти: етилбензен; стирен; фенілацетилен; ізопропілбензен; 2-фенілпропен; 3-фенілпропен (алілбензен); 1-фенілпропен; п-трет -бутилтолуен; п- нітростирен; п- бромобензилбромід; п- бромобензенова кислота;
м- бромобензенова кислота; 1,2-дифенілетан.
7. Опишіть прості хімічні реакції, за допомогою яких можна розрізнити: а) бензен та циклогексан; б) бензен та 1-гексен; в) толуен та н-гептан; г) хлоробензен та етилбензен.
11. Галогеновуглеводні
Галогенопохідними вуглеводнями називаються сполуки, в яких один або більше атомів Гідрогену заміщені атомом (атомами) галогену.
11.1. Класифікація
Залежно від будови вуглеводневого залишку розрізняють алкілгалогеніди та арилгалогеніди. Галогенопохідні мають загальну формулу R–X, де X — F, Cl, Br, I; a R — алкільний залишок, який може бути як ациклічним, так і циклічним; може містити подвійний зв’язок або бензенове кільце, наприклад:

Атом галогену може знаходитися біля первинного, вторинного або третинного атома Карбону. Тому розрізняють первинні, вторинні та третинні алкілгалогеніди, наприклад:
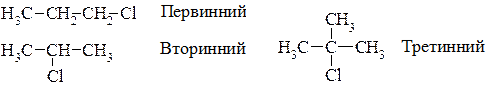
За кількістю атомів галогену в ланцюзі розрізняють моно-, ди- та поліалкілгалогеніди. Алкілдигалогеніди, в яких два атоми галогену сполучені з двома сусідніми атомами Карбону, називаються віцинальними дигалогеналканами; коли два атоми галогену сполучені з одним атомом Карбону – гемінальними. Наприклад:
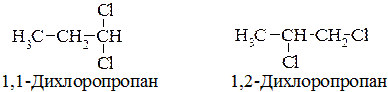
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 20294; Нарушение авторских прав?; Мы поможем в написании вашей работы!