
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування. Методи добування такі ж самі як і монокарбонових кислот
|
|
|
|
Методи добування такі ж самі як і монокарбонових кислот. Тільки як вихідні речовини застосовують сполуки з двома функціональними групами.
1. З спиртів двоатомних

2. З дигалогенопохідних

17.2.2. Фізичні властивості
Усі насичені дикарбонові кислоти – білі кристалічні речовини. Нижчі дикарбонові кислоти добре розчинні у воді. Зі зростанням молекулярної маси розчинність їх зменшується. Дикарбонові кислоти мають порівняно високі температури плавлення.
17.2.3. Хімічні властивості
Хімічні властивості дикарбонових кислот визначаються перш за все наявністю в їх молекулах двох карбоксильних груп.
Дикарбонові кислоти є сильнішими кислотами, ніж монокарбонові кислоти. Посилення властивостей дикарбонових кислот пояснюється взаємним впливом карбоксилів, а саме сильною електроноакцепторною дією однієї карбоксильної групи на другу, яка полегшує дисоціацію:
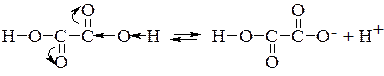
Дикарбонові кислоти виявляють такі ж властивості, як і монокарбонові кислоти. Тільки завдяки наявності двох карбоксильних груп у молекулі вони можуть утворювати два ряди похідних.
Разом з тим наявність двох карбоксильних груп надає дикарбоновим кислотам особливих властивостей.
1. Нагрівання дикарбонових кислот:
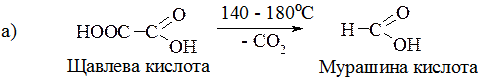

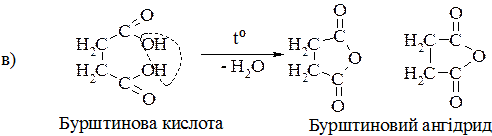

17.2.4. Окремі представники
Щавлева кислота (оксалатна кислота) – біла кристалічна речовина, добре розчинна у воді. Досить поширена в природі. Міститься в щавлі, ревені. Щавлева кислота утворює солі середні і кислі, які називаються оксалатами.
Щавлеву кислоту і її солі використовують при дубленні шкіри, при фарбуванні тканин.
Малонова кислота вперше була добута окисненням яблучної кислоти. Використовується для синтезу органічних кислот, гетероциклічних сполук. Міститься в соках цукрового буряка і ріпи.
Бурштинова кислота – була добута перегонкою бурштину. Бурштинову кислотузастосовують як досить сильний стимулятор росту рослин.
17.3. Ненасичені монокарбонові кислоти
Ненасичені монокарбонові кислоти містять у своєму складі подвійний зв’язок, який у молекулі може бути один або кілька.
Ненасичені одноосновні карбонові кислоти етиленового ряду мають загальну формулу СnH2n-3COOH. Ненасичені одноосновні кислоти називають за систематичною, раціональною, історичною номенклатурами.
Назви деяких ненасичених монокарбонових кислот
| Формула | Систематична | Історична | Раціональна |
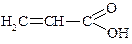
| Пропенова | Акрилова | – |
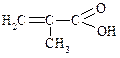
| 2-Метил-2-пропенова | Метакрилова | – |
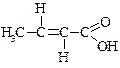
| Транс-2-бутенова | Кротонова | – |
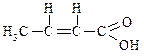
| Цис-2-бутенова | Ізокротонова | – |

| 3-Бутенова | – | Вінілоцтова |
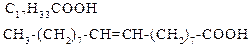
| Олеїнова | (1 подвійний зв’язок) | |
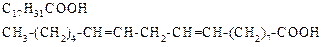
| Лінолева | (2 подвійних зв’язки) | |
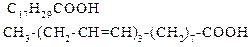
| Ліноленова | (3 подвійних зв’язки) | |

| Арахідонова | (4 подвійних зв’язки) |
Ізомерія ненасичених кислот етиленового ряду починається з С4 і залежить як від положення подвійного зв’язку, так і від структури карбонового ланцюга. Деякі ненасичені кислоти можуть існувати також у вигляді цис- і транс- ізомерів

Хімічні властивості ненасичених одноосновних карбонових кислот зумовлені наявністю в їх молекулах карбоксильної групи і подвійного або потрійного зв’язку.
Ненасичені монокарбонові кислоти виявляють сильніші кислотні властивості і мають вищі константи дисоціації, ніж відповідні їм насичені кислоти. Вплив подвійного зв’язку на кислотні властивості тим сильніший, чим ближче цей зв’язок розміщений до карбоксильної групи.

Ненасичені дикарбонові кислоти.
Найбільший інтерес виявляє симетрична етилендикарбонова кислота  , яка існує у вигляді двох геометричних ізомерів — цис- і транс-:
, яка існує у вигляді двох геометричних ізомерів — цис- і транс-:
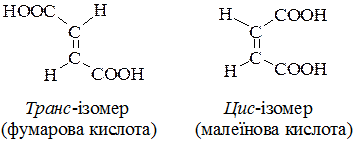
Відмінність у просторовій будові цих кислот зумовлює істотні відмінності в їх властивостях.
Хімічні властивості зумовлені наявністю в молекулах кислот подвійного зв’язку і двох карбоксильних груп.
Більш стійка фумарова кислота. Малеїнова кислота – активніша, легко відщеплює воду і утворює ангідрид.
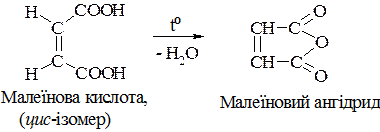
Фумарова кислота міститься в багатьох рослинах: у лишайниках, грибах.
Малеїнова кислота в природі не зустрічається.
Ароматичні двоосновні карбонові кислоти

Це ізомери бензендикарбонової кислоти. Найбільше значення мають: фталева, ізофталева кислоти.
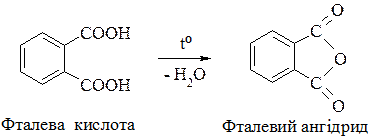
Фталевий ангідрид є вихідною речовиною в органічному синтезі і у виробництві синтетичних смол. [1], c. 375-410; [2], c. 393-421.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3030; Нарушение авторских прав?; Мы поможем в написании вашей работы!