
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методи добування. Найбільш вживаними для нітросполук є назви за систематичною номенклатурою, де сполука розглядається як відповідний вуглеводень
|
|
|
|
Номенклатура
Найбільш вживаними для нітросполук є назви за систематичною номенклатурою, де сполука розглядається як відповідний вуглеводень, а нітрогрупа — як замісник у карбоновому ланцюгу. Крім того, для окремих сполук вживаними є тривіальні назви, наприклад тринітротолуен називають тол, або тротил.

22.1.3. Ізомерія
Ізомерія нітросполук пов'язана з ізомерією: а) карбонового ланцюга;
б) положення нітрогрупи у ланцюгу; в) для полінітросполук — зі взаємним розташуванням нітрогруп в молекулі.
Методи добування нітросполук здебільшого вже були розглянуті під час розгляду хімічних властивостей відповідних класів вуглеводнів:
1. Нітрування алканів за Коноваловим;
2. Нітрування алканів у газовій фазі;.
3. Нітрування аренів у кільце (нітруючою сумішшю) та в бічний ланцюг (розведеною нітратною кислотою).
4. Дія солей нітритної кислоти на галогеналкани – як метод синтезу первинних і вторинних нітросполук:

5. Окиснення амінів зазвичай використовується для добування третинних нітросполук із амінів.

22.1.5. Фізичні властивості
За агрегатним станом аліфатичні нітросполуки здебільшого є рідинами, а ароматичні – рідинами або твердими речовинами. Аліфатичні нітросполуки мають приємний запах, а ароматичні — запах гіркого мигдалю. Густину більшу за одиницю мають усі нітросполуки ароматичного ряду, з аліфатичних — лише чотири перші гомологи, густина наступних (після нітробутану) гомологів менша за одиницю. Всі нітросполуки мають великі значення електричного моменту диполя, високі температури кипіння та плавлення (порівняно з ізомерними їм етерами нітритної кислоти), що пояснюється наявністю в їх молекулах координаційного зв'язку.
22.1.6. Хімічні властивості нітросполук
Хімічна поведінка нітросполук зумовлюється будовою не тільки нітрогрупи, а й вуглеводневого залишку, а також їх взаємним впливом.
1. Нітрогрупа за рахунок свого сильного –І-ефекту спричинює рухливість атомів Гідрогену біля α-карбонового атома, внаслідок чого первинні та вторинні нітросполуки можуть існувати у двох таутомерних формах:
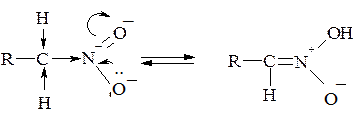
Завдяки цьому первинні і вторинні нітросполуки розчиняються в лугах з утворенням солей. Треба мати на увазі, що це солі не власне нітросполук, а ізомерних їм ізонітросполук, так званих аци -нітроформ. Аци -нітроформи виявляють сильно виражені кислотні властивості:
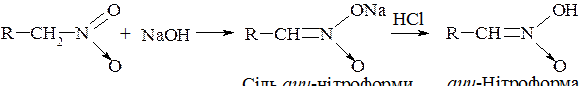
Аналогічно для вторинних нітросполук:
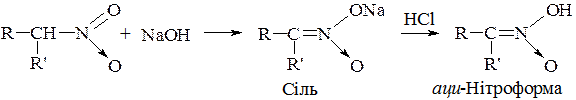
Аци- нітроформа утворена при підкисленні розчину, її солі швидко ізомеризується в нітроформу. Таким чином, аліфатичні нітросполуки є псевдокислотами, оскільки вони самі нейтральні, не мають електропровідності, однак утворюють солі лужних металів.
2. Дія нітритної кислоти є характерною (якісною) реакцією, за якою можна розрізнити первинні, вторинні, третинні нітросполуки. Вона також зумовлена рухливістю атомів Гідрогену в α-положенні до нітрогрупи.
Первинні нітросполуки з нітритною кислотою утворюють нітролові кислоти, лужні солі яких забарвлені в червоний колір:
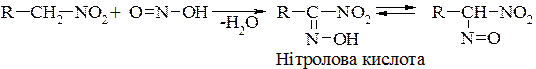
Вторинні нітросполуки при взаємодії з нітритною кислотою також виділяють воду:
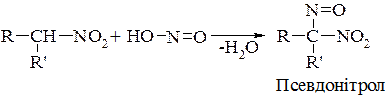
Псевдонітроли у кристалічному стані безбарвні, а в розчинах (в етері, хлороформі тощо) набувають інтенсивного синьо-зеленого забарвлення.
Третинні нітросполуки з нітритною кислотою не реагують.
3. Конденсація з альдегідами, як і дві попередні реакції, можлива за наявності рухливих атомів Гідрогену в α-положенні і відбувається за альдольно-кротоновим типом:
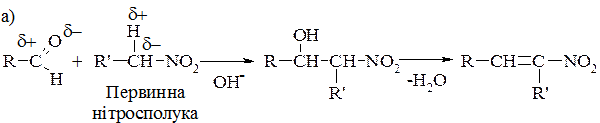

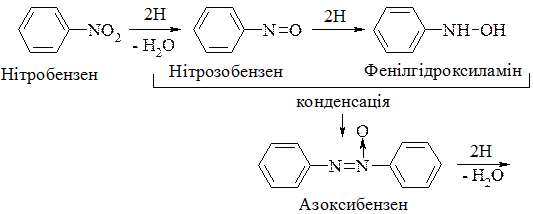
4. Відновлення нітросполук зумовлює утворення первинних амінів. Особливе значення має відновлення ароматичних нітросполук, під час якого синтезуються у промисловому масштабі важливі нітрогеновмісні ароматичні сполуки. Залежно від типу відновника і відповідних умов реакції можна добути різні продукти відновлення. У нейтральному або кислому середовищі реакція відбувається за схемою:

У лужному середовищі утворюється значно більше проміжних продуктів:
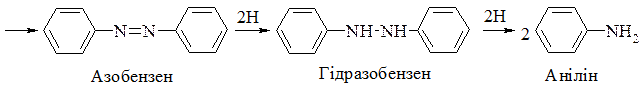
5. Заміщення в бензеновому кільці ароматичних нітросполук. У реакціях електрофільного заміщення в бензеновому кільці (SE) нітрогрупа є орієнтантом другого роду (-М) і в реакціях галогенування, сульфування, алкілювання, ацилювання, нітрування орієнтує відповідні замісники в мета- положення, у той самий час ускладнюючи їх перебіг (тому ці реакції здійснюються за жорсткіших умов, ніж для відповідних ароматичних вуглеводнів):
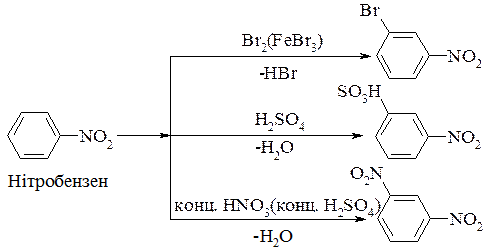
Електрофільне заміщення в кільці ароматичних динітросполук відбувається за значно жорсткіших умов, ніж монопохідних.
22.1.7. Окремі представники
Нітрометан застосовується як розчинник, а також для синтезу хлоропікрину (трихлоронітрометану CHCІ3NО3), який використовується як напівпродукт у синтезах і як родентицид (речовина, що знищує гризунів) у хлібосховищах і на складах.
Нітроциклогексан застосовується як напівпродукт у синтезі капролактаму.
Нітробензен — вихідний продукт у виробництві аніліну, широко використовується в анілінофарбовій, фармацевтичній, парфумерній промисловості.
Тринітротолуен (тол, тротил, ТНТ) — одна з найпоширеніших вибухових речовин. Потужності ядерних зарядів перераховуються на ТНТ. Так ядерна бомба, яку було скинуто на Хіросіму, еквівалентна 20 тис. т ТНТ.
Полінітросполуки — нітроформ CH(NО2)3 і тетранітрометан C(NО2)4 також мають вибухові властивості і дають вибухові суміші з речовинами, що легко окиснюються.
22.2. Аміни
Аміни можна розглядати як продукти заміщення одного або кількох атомів Гідрогену в молекулі амоніаку на вуглеводневі залишки.
22.2.1. Класифікація
1. Залежно від того, скільки атомів Гідрогену заміщено на вуглеводневі залишки (скільки залишків сполучено з атомом Нітрогену), розрізняють первинні R–NH2, вторинні R–NH–R'ітретинні 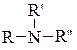 аміни. Первинні аміни містять аміногрупу –NH2, вторинні — іміногрупу –NH–, а третинні — третинний атом Нітрогену
аміни. Первинні аміни містять аміногрупу –NH2, вторинні — іміногрупу –NH–, а третинні — третинний атом Нітрогену 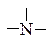 . Відомі також сполуки з четвертинним атомом Нітрогену
. Відомі також сполуки з четвертинним атомом Нітрогену 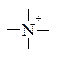
2. Залежно від типу залишку розрізняють аліфатичні (насичені і ненасичені), аліциклічні, ароматичні (такі, що містять аміногрупу, сполучену з ароматичним кільцем), гетероциклічні аміни.
3. Залежно від кількості аміногруп –NH2 (або ж алкіламіногруп –NH R чи діалкіламіногруп –N R2)у молекулі розрізняють моноаміни, діаміни тощо.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3970; Нарушение авторских прав?; Мы поможем в написании вашей работы!