
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление окислительно-восстановительных процессов
|
|
|
|
Задачи
Используя метод электронного баланса, расставить коэффициенты в уравнениях. В необходимых случаях впишите недостающие молекулы воды. Укажите окислители и восстановители.
86. As2S3 + HNO3 → H3AsO4 + NO2 + H2SO4
87. Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2
88. FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO2
89. Cr2Se3 + HNO3 +PbO2 → H2Cr2O7 + PbSeO4 + Pb(NO3)2
90. MoS2 + HNO3 +PbO2 → H2MoO4 + PbSO4 + Pb(NO3)2
91. Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO
92. Fe(CrO2)2 + K2CO3 + O2 → Fe2O3 +K2CrO4 + CO2
93. C + S + KNO3 → N2 + CO2 +K2S
94. FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO
95. As2S3 + HNO3 → H3AsO4 + NO + H2SO4
96. Cu2S + Fe2(SO4)3 → FeSO4 + CuSO4 + S
97. Cr2S3 + HNO3 +PbO2 → H2Cr2O7 + PbSO4 + Pb(NO3)2
98. MoS2 + O2 → SO2 +MoO3
99. Fe(CrO2)2 + C → CO + Fe + Cr
100. As2S3 + H2O2 + NH4OH → (NH4)3AsO4 + (NH4)2SO4 + H2O
101. CuFeS2 + HNO3 → Fe(NO3)3 +CuSO4 + H2SO4 + NO
102. FeS2 + O2 → Fe2O3 + SO2
103. As2S3 + HClO3 → H3AsO4 + H2SO4 + HCl
104. FeS + O2 → Fe2O3 + SO2
105. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2 + H2O
Закончить уравнения реакций, написав их в ионном и молекулярном виде:
106. KMnO4 + MnSO4 +H2O →
107. Sb3+ + Zn +H+ → SbH3 +
108. C2O 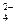 + J
+ J 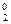 → CO2 +
→ CO2 +
109. PCl3 + ClO 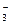 + H2O →
+ H2O →
110. HPO 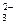 + Hg2+ + H2O → Hg+ +
+ Hg2+ + H2O → Hg+ +
Пример
В кислый раствор, содержащий смесь солей КСl, КВr и KJ, добавлено достаточное количество КNO2. Записать редоксицепи, выражающие взаимодействие иона NO  по отдельности с галогенид–ионом. Сопоставлением электродных потенциалов установить, какой из галогенид–ионов будет окисляться до свободного состояния, а какие не будут. Для окисляющегося галогенид-иона написать молекулярные уравнения реакций.
по отдельности с галогенид–ионом. Сопоставлением электродных потенциалов установить, какой из галогенид–ионов будет окисляться до свободного состояния, а какие не будут. Для окисляющегося галогенид-иона написать молекулярные уравнения реакций.
Решение:
а) редоксицепь: NO 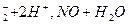 //2Cl–/Cl2
//2Cl–/Cl2
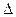 E= φ(окисл)–φ(вос-ля)
E= φ(окисл)–φ(вос-ля)
φ (2Сl–/Сl2)=+1,4 В
φ(NO  +2Н+/NO+Н2О)=+1,2 В
+2Н+/NO+Н2О)=+1,2 В
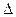 E=1,2 В – 1,4 В = – 0,2 В
E=1,2 В – 1,4 В = – 0,2 В
(ЭДС< 0, реакция не может протекать при н.у.)
б) редоксицепь: NO  + 2H+,NO + H2O//2Br– /Br2
+ 2H+,NO + H2O//2Br– /Br2
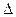 E= φ(окисл)–φ (вос-ля)
E= φ(окисл)–φ (вос-ля)
φ (2Br– /Br2)=+1,09 В
φ(NO  + 2H+/NO + H2O)=+1,2 В
+ 2H+/NO + H2O)=+1,2 В
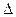 E= 1,2 В – 1,09 В = 0,11 В > 0
E= 1,2 В – 1,09 В = 0,11 В > 0
в) редоксицепь: NO  + 2H+,NO + H2O//2J,J2
+ 2H+,NO + H2O//2J,J2
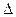 E= φ(окисл)–φ(вос-ля)
E= φ(окисл)–φ(вос-ля)
φ(2J/J2)= 0,53 В
φ(NO  + 2H+/NO + H2O)=+1,2 В
+ 2H+/NO + H2O)=+1,2 В
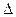 E= 1,2 В – 0,53 В = 0,67 В
E= 1,2 В – 0,53 В = 0,67 В
Протекает тот процесс, ЭДС которого больше нуля т.е. окисление КJ и КBr.
Уравнение реакции:
2КJ+2KNO2+4HCl  2NO
2NO 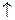 +2H2O+J2+4KCl
+2H2O+J2+4KCl
NO  + 2H+–1e– + 2H+–1e– 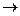 NO+H2O NO+H2O
| |
2J– – 2 e– 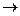 J2 J2
|
2NO  +4H+ +2 J–
+4H+ +2 J– 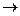 2NO + 2H2O + J2
2NO + 2H2O + J2
С КBr процесс аналогичен.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 778; Нарушение авторских прав?; Мы поможем в написании вашей работы!