
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия
|
|
|
|
Задачи
Составьте схему электродных процессов, суммарную реакцию и гальванический элемент, в котором возможно протекание указанной реакции. Рассчитайте значение стандартной электродвижущей силы.
136. Zn + 4OH– + Sn2+ = ZnO  + 2H2O + Sn
+ 2H2O + Sn
137. Pb + SO 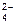 + Sn2+ = PbSO4 + Sn
+ Sn2+ = PbSO4 + Sn
138. 3H2 + Н2SO4 = 4H2O + S0
139. PbSO4 + Ba = Pb + SO 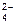 + Ba2+
+ Ba2+
140. Pb + SO 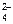 + Ni2+ = PbSO4 + Ni0
+ Ni2+ = PbSO4 + Ni0
141. 2Ag + 2Cl– + J2 = 2AgCl + 2J–
142. Cu + J2 = Cu2+ + 2J–
143. 2AuCl3 = 2Au + 3Cl2
144. 2J– + Br2 = 2Br– + J2
145. Mn2+ + Cl2 + 2H2O = MnO2 + 4H+ + 2Cl–
146. MnO2 + 4OH– + 3Ag+ = MnO 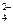 + 2H2O + 3Ag0
+ 2H2O + 3Ag0
147. PbO2 + 4H+ + 2Hg + 2J– = Pb2+ + 2H2O + Hg2J2
148. Sn2+ + NO 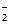 + 2OH– = Sn0 + NO
+ 2OH– = Sn0 + NO 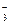 + H2O
+ H2O
149. 2Cr2O  + 16H+ = 3O2 + 4Cr3+ + 8H2O
+ 16H+ = 3O2 + 4Cr3+ + 8H2O
150. Fe3+ + MnO 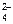 = Fe2+ + MnO
= Fe2+ + MnO 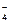
151. MnO2 + 2NO + 2H+ = 2Mn2+ + 2HNO3
152. H2 + 2OH– + 2Ni2+ = Ni + 2H2O
153. H2O2 + Hg2+ = O2 + 2H+ + Hg
154. 2Cl– + PbO2 + 4H+ = Cl2 + Pb2+ + 2H2O
155. PbSO4 + 2H2O + 2Cu2+ = 2Cu+ + PbO2 +4H+ + SO 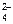
156. PbO2 + 4H+ + 2Hg + 2J– = Pb2+ + 2H2O + Hg2J2
157. 2Ag + 2Br– + Hg2Cl2 = 2AgBr + 2Hg + 2Cl–
158. Hg + PbO = HgO + Pb
159. Ag+ + Cl– = AgCl
160. 2Cr2+ + PbO2 + 4H+ = 2Cr3+ + 2Pb2+ + 2H2O
Коррозия металлов – это разрушение металлов или сплавов под воздействием окружающих условий, в результате чего они теряют присущие им свойства.
Различают химическую и электрохимическую коррозию металлов. Химическая коррозия металлов вызывается окислительно–восстановительными реакциями, происходящими в результате взаимодействия металла с газами и неэлектролитами. Электрохимическая коррозия металлов возникает при контакте двух металлов под воздействием электролитов.
Электродные процессы:
- на аноде окисляется корродирующий металл;
- на катоде происходит восстановление атомов или ионов окружающей среды.
Пример 1
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на пластинках. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводниках.
Решение:
а) Zn + CuSO4 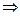 ZnSO4 + Cu
ZnSO4 + Cu
(Цинковая пластина постепенно растворяется, на ней выделяется мет. медь)
Zn0 – 2e 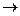 Zn2+ (восстановитель) φ0 = –0,76 В
Zn2+ (восстановитель) φ0 = –0,76 В
Cu2+ + 2e 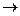 Cu0 (окислитель) φ0 = 0,34 В
Cu0 (окислитель) φ0 = 0,34 В
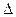 E = φ0 (окислителя) –φ0 (восстановителя)
E = φ0 (окислителя) –φ0 (восстановителя)
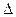 E = 0,34 – (–0,76) = 1,1 В
E = 0,34 – (–0,76) = 1,1 В
б) Fe + CuSO4 = FeSO4 + Cu
(железная пластина растворяется, на ней выделяется металлическая медь)
Fe0 *– 2e 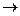 Fe2+ (восстановитель) φ0 = –0,44 В
Fe2+ (восстановитель) φ0 = –0,44 В
Cu2+ + 2e 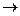 Cu0 (окислитель) φ0 = 0,34 В
Cu0 (окислитель) φ0 = 0,34 В
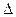 E = φ0 (окислителя) –φ0 (восстановителя)
E = φ0 (окислителя) –φ0 (восстановителя)
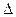 E = 0,34 В – (–0,44 В) = 0,78 В
E = 0,34 В – (–0,44 В) = 0,78 В
Если соединить наружные концы пластинок проводником, то получим гальванический элемент, где пластинки будут играть роль электродов. Согласно значению потенциалов система Zn2++ 2e 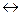 Zn по отношению к системе Fe2+ + 2e
Zn по отношению к системе Fe2+ + 2e 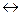 Fe является восстановителем, т.е. в растворе электроны будут переходить от Zn к Fe2+.
Fe является восстановителем, т.е. в растворе электроны будут переходить от Zn к Fe2+.
Zn + Fe2+ = Zn2+ + Fe и Zn – 2e = Zn2+ – анод
Fe2+ + 2e = Fe – катод
Пример 2
Составить схему процесса атмосферной коррозии оцинкованного железа.
Решение: Оцинкованное железо – это железо, покрытое цинком. Стандартные электродные потенциалы (таблица) железа равен –0,44В, цинка равен –0,76В. Т.к. потенциал цинка отрицательнее потенциала железа φ0(Zn/Zn2+) = –0,76 В;
φ0(Fe/Fe2+) = –0,44 В, то цинк является анодом в коррозионном процессе.
Схема реакций:
А(–):Zn – 2e– 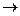 Zn2+
Zn2+
К(+):(Fe)O2 + 4e–+2Н2О 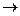 4ОН–
4ОН–
Суммарная реакция с учетом электролитов:
2Zn + O2 + 2H2O 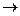 2Zn(OH)2
2Zn(OH)2
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 580; Нарушение авторских прав?; Мы поможем в написании вашей работы!