
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванические элементы
|
|
|
|
Задачи
111. В какую сторону пойдет реакция:
2KJ + PbO2 + 2HgSO4 = J2 + H2SO4 + PbSO4 + 2H2O
112. Определить, может ли ион Fe3+ окислить ион Cl–, Br–, J–, если учесть, что ион Fe3+ восстанавливается до Fe2+?
113. Определить, будет ли протекать реакция при взаимодействии 1М раствора FeSO4 и HgSO4 по схеме:
2FeSO4 + 2HgSO4 = Fe2(SO4)3 + Hg2SO4
114. Перманганат калия можно получить окислением манганата хлором K2MnO4 + Cl2 = KMnO4 + 2KCl. Можно ли вместо хлора использовать Br2 или J2?
115. Определить, может ли KMnO4 окислить NaJ в кислой среде?
116. Определить, будет ли MnO2 в кислом растворе окислять NaBr?
117. Может ли FeSO4 окисляться в Fe2(SO4)3 газообразным кислородом в кислой среде?
118. Сравните восстановительную способность Ca, Zn, Co, Cu по отношению к Cl2.
119. Определить, может ли оксид германия(IV) окислить Mn(NO3)2 в кислом растворе?
120. Определить, может ли KMnO4 окислить в кислой среде хлорид олова(II), если концентрация их раствора равна 1 моль/л.
121. Окислится ли в кислой среде ион Cr3+ в Cr2O  анионом NO
анионом NO  с восстановлением последнего до NO.
с восстановлением последнего до NO.
122. Какой окислитель Br2, H2O2 или HNO3 можно использовать в процессе: CrCl3 ® H2Cr2O7?
123. Какой окислитель Cl2, Br2 или J2 можно использовать в процессе Fe2+ ® Fe3+
124. Какой окислитель H2O2, PbO2 или K2Cr2O7 можно использовать в процессе: MnSO4 ® H2MnO4?
125. Какой окислитель Br2 или HNO3 можно использовать в процессе: H2SO3 ® H2SO4
126. Какой окислитель HClO, J2, или KMnO4 можно использовать в процессе: H2SeO3 ® H2SeO4?
127. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Cu2Cl2 + SnCl4 Û SnCl2 + 2CuCl2
128. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Na2SO3 + J2 + H2O Û Na2SO4 + 2HJ?
129. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
2MnSO4+5Fe2(SO4)3+K2SO4+8H2OÛ2KMnO4+10FeSO4 +8H2SO4?
130. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
2Fe(OH)2 + Br2 + 2H2O Û 2Fe(OH)3 + 2HBr?
131. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
HgO + Pb Û PbO + Hg?
132. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Pb+Hg2SO4Û2Hg+PbSO4
133. Определите направление реакции при 25°C
2Fe(OH)2 + Br2 + 2H2O Û 2Fe(OH)3 + 2HBr,
если для системы Fe2+, Fe3+ aок : авосст = 10–6, а для системы 2Br–, Br2 аок : авосст=10–5
134. Определите направление реакции:
Cu2Cl2+SnCl4 Û 2CuCl2+SnCl2
при с(Cu+) = 0,002 моль/л; с(Cu2+) = 0,2 моль/л; с(Sn2+) = 0,003 моль/л; с(Sn4+) = 0,03 моль/л?
135. Будет ли окислять KMnO4 ионы Br– при а(Н+)=10–3 моль/л; а(MnО2+)=а(MnO  )=1 моль/л.
)=1 моль/л.
Устройства, в которых энергия химической окислительно–восстановительной реакции превращается в электрическую энергию, называются химическими источниками электрической энергии, или гальваническими элементами.
Гальванический элемент состоит из двух электродов, сообщающихся друг с другом. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой элемента (ЭДС).
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов (Е), каждый из которых отвечает полуреакции, протекающей на одном из электродов:
ЭДС=φК –φА
Пример 1
Гальванические элементы составлены по схеме:
а) Fe3+,Fe2+ II Ag+,Ag
Рассчитать ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса, протекающих в реакциях, уравнения которых напишите в ионно-молекулярной и молекулярной форме.
Решение:
а) (–)(Pt)Fe3+,Fe2+//Ag+,Ag(+)
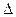 Е (ЭДС) = φ(окислит.) – φ(восстановит.)
Е (ЭДС) = φ(окислит.) – φ(восстановит.)
φ(Fe3+/Fe2+) = 0,77 В (восстановитель находим по таблице)
φ(Ag+/Ag) = 0,80 В (окислитель находим по таблице)
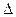 Е= 0,80 В – 0,77 В = 0,03 В
Е= 0,80 В – 0,77 В = 0,03 В
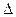 G (Энергия Гиббса) = –n F
G (Энергия Гиббса) = –n F 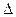 Е
Е
n – число электронов, участвующих в процессе
F – число Фарадея
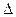 Е – ЭДС
Е – ЭДС
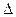 G = –1
G = –1  96485
96485  0,03 В = – 2894,55 Дж = –2,8 кДж
0,03 В = – 2894,55 Дж = –2,8 кДж
Уравнения реакций:
Ag+ + 1e 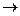 Ag окислитель Ag окислитель
| |
Fe2+– 1e 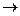 Fe3+ восстановитель Fe3+ восстановитель
|
Ag+ + Fe2+ 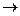 Ag+ Fe3+
Ag+ Fe3+
2AgNO3+Fe(NO3)3 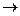 2Ag + Fe(NO3)3
2Ag + Fe(NO3)3
(серебряный и железный электрод опущены в раствор нитратов, которые разделены пористой перегородкой).
Пример 2
Составить схему гальванического элемента, в котором протекает реакция:
Pb + SO 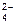 + Sn4+
+ Sn4+ 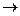 PbSO4 + Sn2+
PbSO4 + Sn2+
Решение: Из справочной таблицы выписываем полуреакции с электродными потенциалами:
Pb + SO 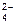 –2e–
–2e– 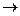 PbSO4; φ0=–0,356 В
PbSO4; φ0=–0,356 В
Sn4+ + 2e– 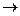 Sn2+; φ0=0,15 В
Sn2+; φ0=0,15 В
Значит, на аноде протекает первый процесс, а на катоде – второй.
Схема гальванического элемента:
 |
(+)Pb, PbSO4, SO 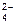 // Sn4+,Sn2+(Pt)(–)
// Sn4+,Sn2+(Pt)(–)
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 734; Нарушение авторских прав?; Мы поможем в написании вашей работы!