
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составление уравнений окислительно-восстановительных реакций по методу электронного баланса
|
|
|
|
Задачи
Классы неорганических соединений
Задачи
31. Сопоставить числа молекул, содержащихся в 1 г NH3 и в 1 г N2. В каком случае и во сколько раз число молекул больше?
32. Выразить в граммах массу одной молекулы диоксида серы.
33. Одинаково ли число молекул в 0,001 кг Н2 и в 0,001 кг О2? В 1 моле Н2 и в 1 моле О2? В 1 л Н2 и в 1 л О2 при одинаковых условиях?
34.Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
35. Какой объем при нормальных условиях занимают 27*1021 молекул газа?
36. Каково соотношение объемов, занимаемых 1 молем О2 и 1 молем О3 (условия одинаковые)?
37. Взяты равные массы кислорода, водорода и метана при одинаковых условиях. Найти отношение объемов взятых газов.
38. На вопрос, какой объем займет 1 моль воды при нормальных условиях, получен ответ: 22,4 л. Правильный ли это ответ?
39. Сколько молекул диоксида углерода находится в 1 л воздуха, если объемное содержание СО2 составляет 0,03 % (условия нормальные)?
40. Вычислить массу: а) 2 л Н2 при 150С и давлении 100,7 кПа (755 мм.рт.ст.); б) 1 м3 N2 при 100С и давлении 102,9 кПа (772 мм.рт.ст.); в) 0,5 м3 Cl2 при 200С и давлении 99,9 кПа (749,3 мм.рт.ст.)
41. Определить объем, занимаемый 0,07 кг N2 при 210С и давление 142 кПа (1065 мм.рт.ст.).
42. Бертолетова соль при нагревании разлагается с образованием KCl и О2. Сколько литров кислорода при 00С и давлении 101,3 кПа можно получить из 1 моля KClO3?
43. Сколько молей содержится в 1 м3 любого газа при нормальных условиях?
44. Чему равно атмосферное давление на вершине Казбека, если при 00С масса 1 л взятого там воздуха равна 700 мг?
45. При взаимодействии одного объема СО и одного объема Cl2 образуется один объем фосгена. Установить формулу фосгена.
46. Какой объем СО2 получается при сгорании 2 л бутана? Объемы обоих газов измерены при одинаковых условиях.
47. В замкнутом сосуде при 1200С и давлении 600 кПа находится смесь, состоящая из трех объемов О2 и одного объема СН4. Каково будет давление в сосуде, если взорвать смесь и привести содержимое сосуда к первоначальной температуре?
48. После взрыва 0,020 л смеси водорода с кислородом осталось 0,0032 л кислорода. Выразить в процентах по объему первоначальный состав смеси.
49. При прохождении смеси равных объемов SO2 и О2 через контактный аппарат 90 % молекул SO2 превращается в SO3. Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
50. Смесь, состоящая из трех объемов Cl2 и одного объема Н2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Cl2 в смеси уменьшилось на 20 %. Изменилось ли давление в сосуде? Каков стал процентный состав смеси по объему?
51. При взаимодействии NH3 с Cl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и Cl2 и каково отношение объемов получающихся газов?
52. Какой объем Н2 (при 170С и давлении 102,4 кПа) выделится при растворении 1,5 кг цинка в соляной кислоте?
53. После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
54. Смесь эквивалентных количеств водорода и кислорода находится в закрытом сосуде при температуре выше 1000С. Как изменится давление в сосуде, если смесь взорвать и затем привести содержимое сосуда к первоначальной температуре?
55. Определить объем, занимаемый 5,25 г азота при 260С и давлении 98,9 кПа (742 мм.рт.ст.).
56.Определите массу и объем 24,08*1023 молекул сероводорода Н2S при 330С и давлении 1,06 кПа.
57. Рассчитайте массу (в граммах) 24,08*1021 молекул сероводорода при 200С и 770 мм.рт.ст.
58. Сопоставить число молекул, содержащихся в 1 г H2SO4 с числом молекул, содержащихся в 1 г HNO3.
59. Какое число молекул содержат в 0,01 моля кислорода, 1/50 молей атомов кислорода, 1/25 эквивалентной массы кислорода?
60. Определите, какое количество молекул содержится в 1 мл брома (ρ=3,1 г/мл)?
Неорганические соединения могут классифицироваться как по составу, так и по свойствам (функциональным признакам). По составу они, прежде всего, подразделяются на двухэлементные (бинарные), и многоэлементные соединения.
К бинарным соединениям относятся, например, соединения элементов с кислородом (оксиды), галогенами (галиды – фториды, хлориды, бромиды, иодиды), серой (сульфиды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), соединения металлов с водородом (гидриды). Названия бинарных соединений образуются из латинского корня названия более электроотрицательного элемента с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже. Так, Al2O3 – оксид алюминия (но OF2 – фторид кислорода, так как фтор – более электроотрицательный элемент, чем кислород).
Исключением из указанных правил являются водородные соединения неметаллов, проявляющие свойства кислот; их названия образуются по правилам, принятым для кислот.
По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных функций, выполняемых ими в химических реакциях. Так, оксиды подразделяются на несолеобразующие (безразличные) и солеобразующие. Последние, в свою очередь, делятся на основные, кислотные и амфотерные.
Существуют соединения элементов с кислородом, которые по составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды, или перекиси.
Важный класс неорганических соединений, выделяемый по функциональным признакам, составляют кислоты. С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода.
Еще один важный класс неорганических соединений, характеризующийся общими свойствами, образуют основания. Согласно теории электролитической диссоциации к ним относятся вещества, способные диссоциировать в растворе с образованием гидроксид-ионов, т.е. основные гидроксиды.
Соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками. При полном замещении атомов водорода в молекуле кислоты образуются средние (нормальные) соли, при неполном – кислые соли (гидросоли). Кислые соли образуются многоосновными кислотами.
При частичном замещении гидроксогрупп в молекуле основного гидроксида кислотными остатками образуются основные соли (гидроксосоли). Основные соли могут быть образованы только многокислотными гидроксида.
Пример. Осуществите превращения согласно схеме:
Ca→Са3Р2 →РН3→Р2О5→Са(Н2РО4)2→Na3PO4→Ca3(PO4)2
Решение:
1. 3Са0+2Р0 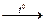 Са3+2Р
Са3+2Р  .
.
2. Са3Р2 + 6Н2О → 3Са(ОН)2↓ + 2РН3↑.
3. 2Р–3Н  + 4О
+ 4О 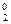
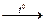 Р
Р 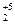 О
О  +3Н
+3Н  О–2.
О–2.
4. Р2О5 + Н2О + Са(ОН)2 →Са(Н2РО4)2;
Р2О5 + Н2О+2ОН–→2Н2РО  .
.
5. 3Са(Н2РО4)2+12NaOH→Са3(РО4)2↓ + 4Na3PO4 + 12H2O;
3Са2+ + 6Н2РО  + 12ОН– → Са3(РО4)2↓ + 4РО
+ 12ОН– → Са3(РО4)2↓ + 4РО 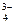 + 12Н2О.
+ 12Н2О.
6. 2Na3РO4 + 3CaCl2 → Ca(PO4)2↓ + 6NaCl.
3Cа2+ + 2PO 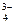 → Ca3(PO4)2↓
→ Ca3(PO4)2↓
Вместо СаСl2 можно использовать любую другую растворимую соль кальция или Са(ОН)2.
61. Осуществите превращения согласно схеме:
HNO3 → NH4NO3 → NH3 → NH4NO2 → N2 →NO2
62. Осуществите превращения согласно схеме:
Fe → Fe2(SO4)3 → Fe → Fe(OH)2 → Fe(OH)3 → FeCl3 → FeCl2
63. Осуществите превращения согласно схеме:
Cu(OH)2 → Cu(NO3)2 → (CuOH)Cl → CuCl2 → (CuOH)NO3
64. Осуществите превращения согласно схеме:
S → ZnS → H2S → SO2 → H2SO4 → Na2SO4 → NaCl
65. Осуществите превращения согласно схеме:
Ca → Ca3P2 → PH3 → P2O5 → Ca(H2PO4)2 → Na3PO4 →Ca3(PO4)2
66. Осуществите превращения согласно схеме:
Na2CO3 → NaHCO3 → CaCO3 → KHCO3 → KCl → KOH → KH
67. Осуществите превращения согласно схеме:
KNO2 → KNO3 → HNO3 → Cu(NO3)2 → NO2 →KNO3 → K2SO4
68. Осуществите превращения согласно схеме:
Ag → AgNO3 → O2 → SO3 →H2SO4 → Ag2SO4
69. Осуществите превращения согласно схеме:
FeS → SO2 → NaHSO3 → Na2SO4 → NaNO3 → SO2 → Ca(HSO3)2
70. Осуществите превращения согласно схеме:
Si → Ca2Si → SiH4 → CaSiO3 → CaO
71 Осуществите превращения согласно схеме:
Fe → FeSO4 → Fe2(SO4)3 → Fe(NO3)3 → Fe(OH)3 →Fe(NO3)3 →Fe2O3 →Fe
72. Осуществите превращения согласно схеме:
Mg → MgO → MgCl2 → Mg(NO3)2 → MgO → Mg(OH)2
73. Осуществите превращения согласно схеме:
N2 → NH3 → NO → NO2 → HNO3 → NaNO3 → NaNO2
74. Осуществите превращения согласно схеме:
Al → Al(NO3)3 → Al(OH)3 → AlCl3 → Al2(SO4)3 → Al(OH)3 → Al2O3
75. Осуществите превращения согласно схеме:
KMnO4 → O2 → Fe3O4 →Fe → FeS → H2S → S
76. Осуществите превращения согласно схеме:
Zn → Na2ZnO2 → Zn(OH)2 → K2 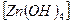 → ZnCl2 → Zn
→ ZnCl2 → Zn
77. Осуществите превращения согласно схеме:
C → CO → CO2 → CO → NaHCO3 → Na2CO3 → CaCO3
78. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
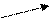 Са3(РО4)2
Са3(РО4)2  СаНРО4
СаНРО4  Са(Н2РО4)2
Са(Н2РО4)2
а) Р  Р2О5
Р2О5  Н3РО4
Н3РО4
Са(Н2РО4)2  СаНРО4
СаНРО4  Са3(РО4)2
Са3(РО4)2
79. Напишите уравнения реакций разложения следующих аммонийных солей: NH4NO2, NH4NO3, (NH4)2CO3, (NH4)2SO4, NH4Cl.
80. При окислении фосфора было израсходовано 16 г кислорода. Полученный фосфорный ангидрид растворили в 50 см3 25%-ного раствора едкого натра (плотность 1,28 г/см3). Какая соль при этом образовалась и какова ее массовая доля в растворе?
81. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) SiO2  Si
Si  Mg2Si
Mg2Si  SiH4
SiH4  Na2SiO3
Na2SiO3  H2SiO3;
H2SiO3;
б) SiCl4  Si
Si  K2SiO3
K2SiO3  H2SiO3
H2SiO3  SiO2
SiO2  стекло;
стекло;
в) Si  SiO2
SiO2  СaSiO3
СaSiO3  H2SiO3
H2SiO3 

 SiC
SiC
Si  SiF4.
SiF4.
82. В трех пробирках имеются растворы силиката натрия, карбоната натрия и сульфида калия. С помощью какого одного реактива можно определить каждый из указанных растворов? Приведите уравнения соответствующих реакций.
83. Приведите примеры реакций, в которых:
а) сернистый газ играет роль кислотного оксида;
б) сернистый газ играет роль окислителя;
в) сернистый газ проявляет восстановительные свойства.
84. Напишите уравнения практически осуществимых реакций:
а. Fe+HCl= е. Fe(OH)3+KCl=
б. Fe2O3+HNO3= ж. FeSO4+Ba(NO3)2=
в. Fe2O3+H2O= з. Fe(OH)2+H2SO4=
г. FeCl2+Cl2= и. FeSO4+NaCl=
д. FeSO4+Cu= k. Fe2O3+Al=
85. Как осуществить следующие превращения:
H2SO3  SO2
SO2  S
S  H2S
H2S  SO2
SO2  SO3
SO3  H2SO4
H2SO4  BaSO4
BaSO4








H2SO4  ZnSO4
ZnSO4  ZnS Na2S
ZnS Na2S  Na2SO4
Na2SO4
Окислительно–восстановительными называются реакции, в результате которых изменяется степень окисления одного или нескольких элементов, входящих в состав реагирующих веществ.
Отдача атомом электронов (сопровождается повышением степени окисления), называется окислением.
Присоединение атомом электронов (сопровождается понижением степени окисления), называется восстановлением.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем; вещество, содержащее восстанавливающийся элемент, называется окислителем.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 1187; Нарушение авторских прав?; Мы поможем в написании вашей работы!