
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчеты по химическим уравнениям
|
|
|
|
Задачи
1. Формалин (формальдегид), уксусная и молочная кислоты, а также глюкоза имеют одинаковый состав: 40,01 % С, 6,66 % Н и 53,33 % О. Молекулярные массы этих веществ соответственно равны: 30, 60, 90 и 180 у.е. Вывести их молекулярные формулы.
2. Красящее вещество крови – гематин – содержит 64,6 % С; 5,2 % Н; 12,6 % О; 8,8 % N и 8,8 % Fe. Молекулярная масса указанного вещества 633. Вывести формулу гематина.
3. 1 литр паров фосгена весит4,42 г (н.у.). Фосген содержит 12,13 % C; 16,17 % О и 71,70 % Сl. Вывести его формулу.
4. 1 литр паров некоторого вещества при нормальном давлении и температуре 8000С весит 1,523 г. Процентный состав вещества: Al – 20.2 % и Cl – 79,8 %. Вывести формулу вещества.
5. Вещество содержит (по массе) 26,53 % калия, 35,37 % хрома и 38,10 % кислорода. Найти его простейшую формулу.
6. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г.
7.Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5 % углерода, 36,4 % кислорода и 9,1 % водорода, зная, что плотность ее паров по водороду равна 44.
8. Найти молекулярную формулу вещества, содержащего (по массе) 93,75 % углерода и 6,25 % водорода, если плотность этого вещества по воздуху равна 4,41.
9. При сгорании 4,3 г углеводорода образовалось 13,2 г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
10. При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г СО2 и 0,3 г Н2О. После превращения всего брома, содержащегося в навеске, в бромид серебра, получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
11. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
12. Найти молекулярную формулу соединения бора с водородом, если масса 1 литра этого газа равна массе 1 литра азота, а содержание бора в веществе составляет 78,2 % (масс.)
13. Вещество содержит азот (массовая доля 82,36 %) и водород. Молекулярная масса его равна 17 г/моль. Найдите молекулярную формулу этого вещества.
14. Молекулярная масса вещества 34. Состав вещества: 5,9 % Н; 94,1 % О. Установите его молекулярную формулу.
15. Газообразное вещество содержит 85,7 % углерода и 14,3 % водорода. Плотность этого вещества по водороду равна 14. Какова молекулярная формула вещества?
Каждое химическое уравнение реакции показывает, в каких количественных соотношениях реагируют исходные вещества и образуются продукты реакции.
Если в условие задачи даются массы или объемы двух исходных веществ, то начинать решение этой задачи следует с выяснения какое исходное вещество дано в избытке, а какое – в недостатке.
Достаточно часто при протекании химических реакций происходят «потери» веществ или имеет место неполное превращение исходных веществ в продукты реакции, в результате чего практически образующаяся масса (объем) того или иного продукта реакции оказывается меньше, чем теоретически рассчитанная по уравнению реакции. В этом случае говорят о практическом выходе, или просто выходе продукта реакции, который обозначается греческой буквой ή (эта):
ή=  (100%) или ή=
(100%) или ή=  (100%),
(100%),
где mпракт. – практически образующаяся масса продукта;
mтеор. – теоретически рассчитанная масса продукта;
Vпракт. и Vтеор. – соответствующие объемы продукта реакции.
Рассчитав по уравнению реакции массу (объем) продукта и зная его выход, можно определить, какая масса (объем) продукта реально образуется:
mпракт= mтеор. * ή или Vпракт.= Vтеор.* ή
Если в условии задачи выход продукта реакции не указан, предполагается, что реакция протекает количественно, т.е. согласно стехиометрическим расчетам.
Для проведения химической реакции во многих случаях берутся не чистые вещества, а вещества, содержащие те или иные примеси. Массовая доля чистого вещества (или массовая доля примесей) указывается в условии задачи или определяется по имеющимся в условии данным.
Пример 1. Смешано 7,3 г HCl с 4,0 г NH3. Сколько граммов NH4Cl образуется?
Решение: Уравнение реакции: NH3+ HCl  NH4Cl
NH4Cl
Определяем, какое вещество находилось в избытке, какое – в недостатке. Для этого рассчитаем данное число молей HCl и NH3:
ν(HCl)=  =0,2 моль
=0,2 моль
ν(NH3)=  =0,24 моль
=0,24 моль
Уравнение реакции показывает, что 1 моль HCl взаимодействует с 1 моль NH3, значит 0,2 моль HCl взаимодействуют с 0,2 моль NH3. Таким образом, 0,04 моль NH3 останутся не прореагировавшими, а значит NH3 дан в избытке. Расчет следует вести по веществу, данному в недостатке, т.е. по HCl:
1 моль HCl – 1 моль NH4Cl
0,2 моль HCl – х моль NH4Cl
х=0,2 моль NH4Cl=ν(NH4Cl)
Рассчитаем молярную массу NH4Cl:
Мr(NH4Cl)=14+4+35,5=53,5 г/моль
Рассчитаем, сколько граммов NH4Cl образуется в результате реакции:
m(NH4Cl)=ν(NH4Cl)* М(NH4Cl)=0,2*53,5=10,7 г
Пример 2. При разложении 42 г карбоната магния MgCO3 по уравнению:
MgCO3 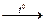 МgO+CO2
МgO+CO2 
образовалось 19 г оксида магния. Чему равен выход МgO?
Решение: Определяем молярные массы MgCO3 и МgO:
Мr(MgCO3)=24+12+3*16=84 г/моль
Мr(МgO)=24+16=40 г/моль
Теоретически ожидаемую массу МgO вычисляем на основе химического уравнения из пропорции:
из 84 г MgCO3 образуется 40 г МgO
из 42 г MgCO3 образуется х г МgO
х= 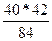 =20 г
=20 г
Принимая 20 г МgO за 1 (или 100 %), определяем выход МgO:
ή=  =
= 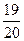 =0,95 (95 %)
=0,95 (95 %)
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 2126; Нарушение авторских прав?; Мы поможем в написании вашей работы!