
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вывод химической формулы вещества по его количественному составу
|
|
|
|
Стехиометрические расчеты по формулам веществ и химическим уравнениям
Распределение часов учебного плана по формам обучения и видам занятий
Требования к знаниям и умениям по дисциплине.
После изучения дисциплины студент должен иметь целостное представление о процессах и явлениях, происходящих в неживой и живой природе, понимать возможность современных научных методов познания природы и владеть ими на уровне, необходимом для решения задач, имеющих естественнонаучное содержание и возникающие при выполнении профессиональных функций.
Иметь представление:
- об основных химических процессах и системах;
- о взаимосвязи между свойствами химической системы, природой веществ и их реакционной способностью;
- о методах химической идентификации и определения веществ.
Требования к минимуму содержания дисциплины.
Химические системы: растворы, дисперсные системы, электрохимические системы, катализаторы и каталитические системы, полимеры и олигомеры;
химическая термодинамика и кинетика: энергетика химических процессов, химическое и фазовое равновесие, скорость реакции и методы ее регулирования, колебательные реакции;
реакционная способность веществ: химия и периодическая система элементов, кислотно-основные и окислительно-восстановительные свойства веществ, химическая связь, комплементарность, свойства металлов и их соединений;
химическая идентификация: качественный и количественный анализ, аналитический сигнал, химический, физико-химический и физический анализ.
| Виды занятий | Заочное обучение |
| 1 семестр | |
| Количество занятий | |
| Лекции | |
| Лабораторные занятия | |
| Самостоятельная работа | |
| Всего | |
| Итоговый контроль (зачеты, экзамены) | Экзамен, 2 к.р. |
Для того чтобы вывести простейшую химическую формулу вещества, необходимо знать весовой состав и атомные массы образующих его элементов.
Пример 1. В состав сульфата натрия входят: Na – 32,43 %, S – 22,55 %, О – 45,02 %. Вывести простейшую формулу вещества.
Решение. Расчет удобно делать в виде таблицы:
| Элемент | Процентный состав | Весовой состав, г | Молярные массы атомов | Состав вещества (моль атомов) | Наименьшие целые числа, представляющие собой отношение количества вещества, а следовательно, и атомов в молекуле вещества | Химическая формула |
| Na | 32,43 | 32,43 | 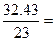 1,41 1,41
| Na2SO4 | ||
| S | 22,55 | 22,55 | 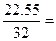 0,705 0,705
| |||
| O | 45,02 | 45,02 | 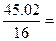 2,814 2,814
|
Для того чтобы было легче подобрать целые числа грамм-атомов, дробные значения нужно разделить на наименьшее из них:
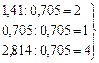 Na2SO4
Na2SO4
Расчет химической формулы по схеме, представленной в приведенной таблице, можно вести и в углеродных единицах.
Если известна молекулярная масса вещества и содержание отдельных элементов (в %), нетрудно установить его химическую формулу.
Пример 2. Ацетилен имеет состав: 92,3 % С и 7,7 % Н. 1 литр ацетилена весит 1,17 г (н.у.)
Решение: Плотность ацетилена по водороду DH=1,17:0,09=13. Молекулярный вес газа по формуле M=2D равен 26 у.е. Из этого количества 92,3 % приходится на долю углерода, что составляет 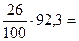 24 у.е. На долю водорода приходится 26 у.е.–24 у.е.=2 у.е.; 24 у.е. углерода – это вес двух атомов С; 2 у.е. – это вес двух атомов Н. Следовательно, молекулярная формула ацетилена – С2Н2.
24 у.е. На долю водорода приходится 26 у.е.–24 у.е.=2 у.е.; 24 у.е. углерода – это вес двух атомов С; 2 у.е. – это вес двух атомов Н. Следовательно, молекулярная формула ацетилена – С2Н2.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 815; Нарушение авторских прав?; Мы поможем в написании вашей работы!