
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комбинированные задачи 1 страница
|
|
|
|
Задачи
186. Составьте уравнение реакций, протекающих на электродах при электролизе водного раствора сульфата железа (III) при нерастворимом аноде. Рассчитайте массу и объём выделившихся веществ на электродах при токе 10А и времени 0,5ч, при температуре 17°С и давлении 95,76кПа. Выход по току составил 98%.
187. Какова была сила тока при электролизе водного раствора нитрата серебра, если в течение 15мин. был выделен весь металл из 300мл 0,5М раствора. Напишите уравнения реакций, протекающих на электродах.
188. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора хлорида меди (II) при нерастворимом аноде. Рассчитайте массу и объём выделившихся веществ при токе 4А и времени 1,5ч при температуре 17°С и давлении 750мм рт.ст. Выход по току составил 85%.
189. Какова была сила тока при электролизе водного раствора нитрата свинца (II), если за 20 мин. был выделен весь металл из 500мл 0,1н раствора. Напишите уравнения протекающих реакций на электродах.
190. При пропускании тока через раствор сульфата никеля (II) за 40мин. на катоде выделилось 30г никеля. Какой газ и в каком объёме выделился за это время на аноде при 17°С и давлении 740мм рт.ст.? Определите силу тока.
191. При пропускании тока через раствор сульфата железа (III) в течение 50мин. на катоде выделилось 56г железа. Какой газ и в каком объёме выделится на аноде при 27°С и давлении 95,76кПа? Составьте уравнение реакций, протекающих на электродах?
192. Составьте уравнения реакции водного раствора нитрата свинца (II). Какой объём 0,1н раствора был взят, если для полного превращения электролита потребовалось 1,5ч? Сила тока равна 4А.
193. Составьте уравнение реакций, протекающих на электродах при электролизе водного раствора сульфата натрия при нерастворимом аноде. Какова масса и объём выделившихся веществ на электродах при пропускании тока силой 5А в течение 0,5ч? Температура 20°С и давление 98,42кПа.
194. Какова была сила тока при электролизе водного раствора сульфата меди (II), если в течение 10мин. был выделен весь металл из 250мл 0,25н раствора. Напишите уравнения протекающих реакций.
195. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата железа (II) при нерастворимом аноде. Рассчитайте массу и объём выделившихся на электродах веществ при токе 5А в течение 2ч. при температуре 17°С и давлении 740мм рт.ст. Выход по току составил 90%.
196. При пропускании тока через раствор сульфата железа (III) в течение 20мин. на катоде выделилось 28г железа. Какой газ и в каком объёме выделился на аноде при 20°С и Р=95,75кПа?
197. При пропускании тока через водный раствор хлорида кобальта (II) в течение 50мин. на катоде выделилось 56г Со. Какой газ и в каком объёме выделился на аноде при электролизе водного раствора этой соли при Т=300°К и Р=98,42кПа? Составьте уравнения электродных процессов.
198. Какие вещества выделяются на электродах при электролизе водного раствора хлорида алюминия? Напишите уравнения соответствующих реакций. Рассчитайте массы и объёмы продуктов электролиза, если его проводили при следующих условиях: ток 2А, время 1,2ч, Т=298°К и Р=745мм рт.ст. Выход по току 95%.
199. Какова нормальность водного раствора нитрата серебра, если для выделения всего серебра из 80мл этого раствора потребовалось пропустить ток 0,8А в течение 20мин.
200. При электролизе током 4А в течение 40мин. на катоде выделилось 9,084г металла. Вычислите электрохимический эквивалент этого металла в г/A*ч.
201. При рафинировании меди (электролиз водного раствора сульфата меди (II) с растворимым медным анодом) током силой 30А в течение 4ч. выделилось 224г меди. Определите выход по току?
202. Сколько граммов меди выделится на катоде при пропускании через раствор хлорида меди (II) тока силой 8А в течение 10мин. Выход по току равен 90%. Напишите уравнения реакций, протекающих на электродах при электролизе с нерастворимым анодом.
203. Напишите схему процесса электролиза водного раствора сульфата меди (II) и рассчитайте объём кислорода при 17°С и 750мм рт.ст., выделившегося на аноде, если на катоде за это время выделилось 0,318г меди?
204. Водный раствор едкого натра подвергли электролизу током 10А в течение 268ч. После окончания электролиза осталось 100г 24%-ного раствора гидроксида натрия. Найдите первоначальную концентрацию раствора?
205. При пропускании постоянного тока силой 6,4А в течение 30мин. через расплав хлорида неизвестного металла на катоде выделилось 1,07г металла. Определите состав соли, которую подвергли электролизу?
206. Чтобы посеребрить медную пластинку массой 10г, её опустили в стакан, содержащий 250г 20%-ного раствора нитрата серебра. Когда пластинку вынули, оказалось, что масса нитрата серебра в растворе уменьшилась на 20%. Какой массой стала посеребренная пластинка и какова концентрация оставшегося раствора нитрата серебра?
207. Электролиз 300г 8%-ного раствора сульфата меди (II) продолжали до тех пор, пока масса раствора не уменьшилась на 20,5г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах?
208. Электролиз 5%-ного раствора сульфата меди (II) продолжали до тех пор, пока массовая доля растворенного вещества не стала равной 7%. На одном графике изобразите зависимость от времени количества всех веществ, выделившихся на инертных электродах. На другом графике (в тех же масштабах времени) изобразите зависимость массы раствора от времени. Объясните качественные особенности приведенных графиков.
209. При электролизе водного раствора хлорида кальция на катоде выделилось 5,6л водорода. Какой газ и какой массы и объёма выделился при этом на аноде при нормальных условиях?
210. Составьте схему электролитического получения алюминия в промышленности из оксида алюминия с угольными электродами. Как изменится масса угольного анода, если при электролизе выделится 50г алюминия, выход по току 100%.
211. Определите массовую долю (%) примесей в техническом карбиде кальция, если при полном разложении 1,8 кг образца водой образовалось 560 л ацетилена.
212. Определите массу Na2O2, вступившую в реакцию с водой, если общий объем полученного раствора NaOH 0,750 л, а 0,010 л этого раствора необходимо для нейтрализации 0,030 л 0,1 Н Hcl.
213. Вычислите тепловой эффект реакции: 2Mg+CO2  MgO+C,
MgO+C,
если известно, что  = –601,24 кДж/моль, а
= –601,24 кДж/моль, а  = –393,51 кДж/моль.
= –393,51 кДж/моль.
214. Найдите объем сероводорода, выделившегося при взаимодействии 60 г магния с 500 мл раствора серной кислоты (r = 1455 кг/м3) с массовой долей H2SO4 55,5% при температуре 180С и давлении 96 кПа.
215. Вычислите массу MgSO4 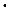 7H2O, содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
7H2O, содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
216. Определите массовую долю (%) разложившегося карбоната стронция, если при прокаливании 10 кг карбоната стронция его масса уменьшилась на 1,7 кг.
217. Смесь карбоната и гидроксида кальция, содержащую 45% карбоната кальция, обработали раствором соляной кислоты (r = 1200 кг/м3) с массовой долей Hcl 39%. Вычислите массу исходной смеси и объем соляной кислоты, вступившей в реакцию, если при этом выделилось 1,4 л газа (н.у.).
218. Рассчитайте количество теплоты, которое выделится при 250С при взаимодействии 12 г гидрида калия с водой, если  KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
219. При растворении в кислоте 7,5 г оксида кальция, содержащего примесь карбоната кальция, выделилось 0,21 л газа (н.у.). Какова массовая доля (%) карбоната кальция в исходной смеси?
220. Магний раньше получали восстановлением хлорида магния с помощью натрия. Вычислить теплоту реакции, зная, что теплота образования MgCl2 равна 623,4 кДж, а теплота образования NaCl равна 409,5 кДж.
221. Хлор и водород, получаемые электролизом раствора NaCl, используют для производства соляной кислоты. Сколько кубических метров 18%-ного раствора поваренной соли (r=1,132 г/см3) должно быть подвергнуто электролизу, чтобы получить 1 т 30%-ного раствора соляной кислоты?
222. При прокаливании 30 г кристаллогидрата сульфата калия выделяется 6,28 г воды. Какова формула кристаллогидрата?
223. Если C 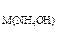 = 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (r = 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
= 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (r = 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
224. Какой объем (н.у.) CO2 можно получить из 1246 г мрамора, в котором массовая доля CaCO3 составляет 89,6%? Какой объем соляной кислоты с массовой долей 20% для этого потребуется?
225. Раствор NaNO2, молярная концентрация эквивалента которого равна 0,1 экв/л, взят объемом 25 мл. Какой объем раствора KMnO4 той же концентрации потребуется для окисления нитрита в сернокислой среде?
226. Какой объем раствора нитрита натрия, молярная концентрация которого 0,15 моль/л, потребуется для реакции с 10 мл раствора KJ (r = 1,12 г/мл), в котором его массовая доля соли составляет 15%. В какой среде протекает эта реакция? Вычислите массу каждого из образующихся продуктов.
227. Какая масса PbO2 потребуется для окисления в присутствии серной кислоты нитрита натрия, находящегося в 200 мл раствора (r = 1,12 г/мл)?
228. Какой объем раствора KNO2 концентрации 1 моль/л потребуется для выделения в кислой среде всего йода из 20 мл раствора KJ (r = 1,12 г/мл), в котором массовая доля KJ составляет 15%?
229. Какой объем раствора NaOH концентрации 0,1 моль/л необходимо взять для нейтрализации Н3РО4, полученной из фосфата кальция массой 0,31 г?
230. Чему равен объем кислорода (н.у.), полученного из KClO3 и KMnO4, взятых массой по 1 кг?
231. Какой объем SO2 (н.у.) потребуется для полного обесцвечивания раствора KMnO4 объемом 250 мл, если его молярная концентрация эквивалента составляет 0,1 моль/л?
232. Найдите объем хлора, который выделится при взаимодействии K2Cr2O7 с раствором соляной кислоты объемом 250 мл, в котором массовая доля HСl составляет 30%, r = 1,48 г/см3).
233. Какой массы йод может быть получен при взаимодействии насыщенного раствора KJ: а) с хлором, объем которого равен 28 л (н.у.); б) с раствором объемом 50 мл, в котором массовая доля H2SO4 составляет 98%?
234. Найдите массу брома, который поглощается раствором гидроксида натрия объемом 300 мл, если С 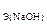 = 2 моль/л.
= 2 моль/л.
235. Газ, выделившийся при взаимодействии NaCl массой 5,85 г с концентрированной серной кислотой, пропущен через раствор AgNO3 (r = 1,1 г/мл) объемом 200 мл, в котором массовая доля соли равна 10%. Найдите массы образовавшегося при этом осадка и AgNO3, оставшегося в растворе.
236. Какой объем (н.у.) хлора потребуется для взаимодействия с 10 мл горячего раствора Ba(OH)2, в котором массовая доля гидроксида составляет 3,75% (r = 1,04 г/мл).
237. Напишите уравнение реакции получения металлического хрома из окиси хрома алюминотермическим способом. Сколько металлического алюминия потребуется для получения 10 кг хрома?
238. Олово получают восстановлением оловянной руды SnO2 углем по схеме: SnO2 + С  Sn + CO2. Сколько тонн металлического олова можно получить из 10 т руды, содержащей 92% SnO2?
Sn + CO2. Сколько тонн металлического олова можно получить из 10 т руды, содержащей 92% SnO2?
239. Сколько аммиачной селитры получается при нейтрализации 50 г 40% HNO3 аммиаком?
240. Какой объем хлора вступил в реакцию с натрием, если выделилось 49,11 ккал тепла?
241. Сколько необходимо хлористого водорода и воды для получения 1 кг 33%-ной соляной кислоты?
242. Молярная концентрация эквивалента раствора K2Cr2O7 0,25 моль/л. Какой объем этого раствора надо взять для реакции с KJ в подкисленном серной кислотой растворе, содержащем йодид-ионы количеством вещества 0,01 моль?
243. Какой объем раствора с массовой долей HNO3 8% (r = 1,045 г/см) потребуется для растворения меди массой 24 г? Чему должен быть равен объем NO (н.у.), который при этом выделится?
244. Чем объяснить, что при большом различии в свойствах соединений марганца и хлора в низших валентных состояниях соединения этих же элементов в высших валентных состояниях имеют сходство? Сравнить Cl2O и MnO; Cl2O7 и Mn2O7.
245. Чем объяснить, что химическая активность d-металлов понижается по периоду и по группам Периодической системы, в результате наименее активные, благородные металлы (Pd, Pt, Au и т.д.) концентрируются в VIII и I группах V-VI периодов системы?
246. Сравнить кислотно-основной характер гидроксидов CuOH и Cu(OH)2. Какой из этих гидроксидов обладает амфотерными свойствами? Написать уравнения реакций, подтверждающих его амфотерный характер.
247. Какую массу хрома можно получить из 2,5 т хромистого железняка FeO 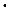 Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
248. На восстановление 0,05 л 0,2 Н K2Cr2O7 в присутствии разбавленной соляной кислоты затрачено 0,2 л раствора хлорида олова (II). Вычислите молярную концентрацию эквивалента раствора SnCl2.
249. Вычислите, какая масса дихромата калия потребовалась для приготовления 0,3 л 0,2 Н K2Cr2O7 (применительно к реакции окисления в кислой среде).
250. Кусок латуни массой 0,8 г растворен в азотной кислоте. При электролизе этого раствора на катоде выделилось 0,496 г меди. Напишите уравнения реакций и определите марку латуни, т.е. состав сплава (%).
Таблица 1
Стандартные электродные потенциалы
| ЭЛЕКТРОД | ЭЛЕКТРОДНАЯ РЕАКЦИЯ | φ0 в водных растворах при 250С |
| Li / Li+ | Li+ + e  Li0 Li0
| -3,045 |
| K / K+ | K+ + e  K0 K0
| -2,925 |
| Ba / Ba2+ | Ba2+ + 2e  Ba0 Ba0
| -2,90 |
| Sr / Sr2+ | Sr2+ + 2e  Sr0 Sr0
| -2,89 |
| Ca / Ca2+ | Ca2+ + 2e  Ca0 Ca0
| -2,87 |
| Na / Na+ | Na+ + e  Na0 Na0
| -2,714 |
| Mg / Mg2+ | Mg2+ + 2e  Mg0 Mg0
| -2,07 |
| Ti / Ti2+ | Ti2+ + 2e  Ti0 Ti0
| -1,75 |
| Be / Be2+ | Be2+ + 2e  Be0 Be0
| -1,70 |
| Al / Al3+ | Al3+ + 3e  Al0 Al0
| -1,66 |
| V / V2+ | V2+ + 2e  V0 V0
| -1,50 |
| Mn / Mn2+ | Mn2+ + 2e  Mn0 Mn0
| -1,18 |
SO  , SO , SO  (Pt) (Pt)
| SO  +2e + H2O +2e + H2O  SO SO  + 2OH- + 2OH-
| -0,90 |
| Cr / Cr2+ | Cr2+ + 2e  Cr0 Cr0
| -0,86 |
NO2(г), NO  (Pt) (Pt)
| NO  + e + H2O + e + H2O  NO2(г) + 2OH- NO2(г) + 2OH-
| -0,85 |
| Н2, Н2О (Pt) | 2Н2О + 2e  Н2 + 2ОН– Н2 + 2ОН–
| -0,83 |
| Zn / Zn2+ | Zn2+ + 2e  Zn0 Zn0
| -0,763 |
| Cr / Cr3+ | Cr3+ + 3e  Cr0 Cr0
| -0,74 |
S2O  , SO , SO  (Pt) (Pt)
| 2 SO  +4e + 3H2O +4e + 3H2O  S2O S2O  +6OH- +6OH-
| -0,58 |
| Pb, PbO, OH- | PbO + 2e + H2O  Pb0 + 2OH- Pb0 + 2OH-
| -0,578 |
| Fe(OH)2, Fe(OH)3 (Pt) | Fe(OH)3 + e  Fe(OH)2 + OH- Fe(OH)2 + OH-
| -0,56 |
| S / S2- | S + 2e  S2- S2-
| -0,48 |
| Fe / Fe2+ | Fe2+ + 2e  Fe0 Fe0
| -0,44 |
| Cd / Cd2+ | Cd2+ + 2e  Cd0 Cd0
| -0,402 |
Pb, PbSO4, SO 
| PbSO4 + 2e  Pb0 + SO Pb0 + SO 
| -0,356 |
| Co / Co2+ | Co2+ + 2e  Co0 Co0
| -0,27 |
| Ni / Ni2+ | Ni2+ + 2e  Ni0 Ni0
| -0,25 |
| Ag, AgI, I- | AgI + e  Ag0 + I- Ag0 + I-
| -0,152 |
| Ge, GeO2, H+ | GeO2 + 4e + 4H+  Ge0 + 2H2O Ge0 + 2H2O
| -0,15 |
| Sn / Sn2+ | Sn2+ + 2e  Sn0 Sn0
| -0,14 |
| Pb / Pb2+ | Pb2+ + 2e  Pb0 Pb0
| -0,126 |
Продолжение таблицы 1
| Hg, Hg2I2, I- | ½ Hg2I2 + e  Hg0 + I- Hg0 + I-
| -0,040 |
| Fe, Fe3+ | Fe3+ + 3e  Fe0 Fe0
| -0,036 |
| Н2, Н+ (Pt) | Н+ + e  1/2Н2 1/2Н2
| 0,000 |
NO  , NO , NO  (Pt) (Pt)
| NO  + 2e + H2O + 2e + H2O  NO NO  + 2OH- + 2OH-
| 0,01 |
| Ag, AgBr, Br- | 2AgBr + 2e  2Ag0 + 2Br- 2Ag0 + 2Br-
| 0,071 |
| Hg, Hg2Br2, Br- | ½ Hg2Br2 + e  Hg0 + Br- Hg0 + Br-
| 0,140 |
| Sn2+, Sn4+ (Pt) | Sn4+ + 2e  Sn2+ Sn2+
| 0,150 |
| Cu+, Cu2+ (Pt) | Cu2+ + e  Cu+ Cu+
| 0,153 |
| Bi, Bi3+ | Bi3+ + 3e  Bi0 Bi0
| 0,21 |
| Ag, AgCl, Cl- | AgCl + e  Ag0 + Cl- Ag0 + Cl-
| 0,222 |
| Hg, Hg2Cl2, Cl- | ½ Hg2Cl2 + e  Hg0 + Cl- Hg0 + Cl-
| 0,268 |
| Cu / Cu2+ | Cu2+ + 2e  Cu0 Cu0
| 0,34 |
| [Fe(CN)6]4-, [Fe(CN)6]3- (Pt) | [Fe(CN)6]3- + e  [Fe(CN)6]2- [Fe(CN)6]2-
| 0,36 |
| О2, ОН– | Н2О + 2e + 1/2О2  2ОН– 2ОН–
| 0,401 |
| Co / Co3+ | Co3+ + 3e  Co0 Co0
| 0,43 |
| Cu / Cu+ | Cu+ + e  Cu0 Cu0
| 0,52 |
| I2(тв), I- | ½ I2 + e  I- I-
| 0,536 |
MnO  , MnO , MnO  (Pt) (Pt)
| MnO  + e + e  MnO MnO 
| 0,54 |
MnO2, MnO 
| MnO  + 2e + H2O + 2e + H2O  MnO2 + 4OH- MnO2 + 4OH-
| 0,58 |
Hg, Hg2SO4, SO 
| Hg2SO4 + 2e  2Hg0 + SO 2Hg0 + SO 
| 0,615 |
| Hg2Cl2, HgCl2 | 2HgCl2 + 2e  Hg2Cl2 + 2Cl- Hg2Cl2 + 2Cl-
| 0,62 |
U4+, UO  , H+ (Pt) , H+ (Pt)
| UO  + e + 4H+ + e + 4H+  U4+ + 2H2O U4+ + 2H2O
| 0,62 |
| Pb, PbO2, H+ | PbO2 + 4e + 4H+  Pb0 + 2H2O Pb0 + 2H2O
| 0,67 |
| H2O2, O2, H+ | O2 + 2e + 2H+  H2O2 H2O2
| 0,68 |
| Хинон, гидрохинон, Н+ (Pt) | C6H4O2 + 2e + H+  C6H4(OH)2 C6H4(OH)2
| 0,699 |
| Fe2+, Fe3+ (Pt) | Fe3+ + e  Fe2+ Fe2+
| 0,771 |
Hg / Hg 
| Hg  + 2e + 2e  2Hg0 2Hg0
| 0,798 |
| Ag / Ag+ | Ag+ + e  Ag0 Ag0
| 0,799 |
| Hg / Hg2+ | Hg2+ + 2e  Hg0 Hg0
| 0,86 |
Hg  , Hg2+ (Pt) , Hg2+ (Pt)
| 2Hg2+ + 2e  Hg Hg 
| 0,94 |
| Br, Br- | ½ Br2 + 2e  Br- Br-
| 1,066 |
| О2, Н2О, Н+ (Pt) | 4Н+ + О2 + 4e  2Н2О 2Н2О
| 1,23 (1,5)* |
| Mn2+, MnO2 | MnO2 + 2e + 4H+  Mn2+ + 2H2O Mn2+ + 2H2O
| 1,28 |
| Cl2, Cl- (Pt) | ½ Cl2 + e  Cl- Cl-
| 1,36 |
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 1645; Нарушение авторских прав?; Мы поможем в написании вашей работы!