
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление переноса электронов в ЭТЦ определяется редокс-потенциалом переносчиков
|
|
|
|
Создание Δ  сопряжено с электронным транспортом в тилакоидной и митохондриальной мембранах. Рассмотрим, что представляет собой ЭТЦ и какие события в ней происходят. Прежде всего нужно сказать, что электронный транспорт связан с происходящими в мембране окислительно-восстановительными реакциями.
сопряжено с электронным транспортом в тилакоидной и митохондриальной мембранах. Рассмотрим, что представляет собой ЭТЦ и какие события в ней происходят. Прежде всего нужно сказать, что электронный транспорт связан с происходящими в мембране окислительно-восстановительными реакциями.
В широком смысле слова окислением называется процесс, связанный с отдачей электронов (е  ), а восстановлением — процесс, связанный с их присоединением. Соединение, присоединяющее электроны, является акцептором, а отдающее электроны — донором электронов. Окисленная и восстановленная формы соединения, способного отдавать и принимать е
), а восстановлением — процесс, связанный с их присоединением. Соединение, присоединяющее электроны, является акцептором, а отдающее электроны — донором электронов. Окисленная и восстановленная формы соединения, способного отдавать и принимать е  , называется окислительно-восстановительной, или редокс-парой: донор электронов ↔акцептор электронов + п е
, называется окислительно-восстановительной, или редокс-парой: донор электронов ↔акцептор электронов + п е  .
.
Способность данной редокс-пары быть донором или акцептором е  определяется на основе окислительно-восстановительного, или редокс-потенциала, Е', выраженного в вольтах:
определяется на основе окислительно-восстановительного, или редокс-потенциала, Е', выраженного в вольтах:
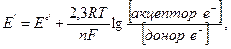
где R — газовая постоянная (8,314 Дж ∙ моль 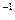 ∙ К
∙ К 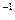 ); Т — абсолютная температура, К; п — число переносимых электронов; F— число Фарадея (96,4 кДж ∙ В-1 ∙ моль
); Т — абсолютная температура, К; п — число переносимых электронов; F— число Фарадея (96,4 кДж ∙ В-1 ∙ моль 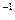 ); [акцептор е
); [акцептор е 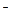 ], [донор е
], [донор е 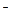 ]— концентрации в молях окисленной и восстановленной форм редокс-пары; Е°' — стандартный редокс-потенциал.
]— концентрации в молях окисленной и восстановленной форм редокс-пары; Е°' — стандартный редокс-потенциал.
Стандартный потенциал Е°' определяется экспериментально. Помещая электрод в раствор, содержащий данную редокс-пару, можно измерить э.д.с. цепи, составленной из данного электрода и электрода сравнения. В качестве стандарта используется водородный электрод (потенциал реакции Н2 = 2 е 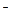 + 2Н+ при давлении газообразного Н2 1 атм, концентрации ионов водорода 1М (рН 0) и 25 °С условно принят за нуль). В биохимии электродные потенциалы Е°' определяются при рН 7,0. Потенциал водородного электрода равен -0,42 В.
+ 2Н+ при давлении газообразного Н2 1 атм, концентрации ионов водорода 1М (рН 0) и 25 °С условно принят за нуль). В биохимии электродные потенциалы Е°' определяются при рН 7,0. Потенциал водородного электрода равен -0,42 В.
По определению, Е°' (или потенциал средней точки Ет7) равен ЭДС, возникающей в полуэлементе, содержащем донор и акцептор е 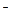 в равной концентрации (при 25 °С и рН 7,0) и находящемся в равновесии с электродом, способным обратимо принимать электроны. Значение Е°' характеризует способность данной редокс-пары быть донором или акцептором электронов и позволяет предсказать направление переноса е
в равной концентрации (при 25 °С и рН 7,0) и находящемся в равновесии с электродом, способным обратимо принимать электроны. Значение Е°' характеризует способность данной редокс-пары быть донором или акцептором электронов и позволяет предсказать направление переноса е 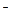 от одной редокс-пары к другой при стандартных условиях. Система с более положительным Е°' может быть окислителем по отношению к системе с более отрицательным Е°'. Например, редокс-пара НАДН/НАД+ имеет потенциал -0,32 В, что указывает на сильно выраженную способность НАДН к отдаче электронов. Наоборот, Е°' пары Н2О /
от одной редокс-пары к другой при стандартных условиях. Система с более положительным Е°' может быть окислителем по отношению к системе с более отрицательным Е°'. Например, редокс-пара НАДН/НАД+ имеет потенциал -0,32 В, что указывает на сильно выраженную способность НАДН к отдаче электронов. Наоборот, Е°' пары Н2О / 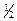 О2 составляет +0,82 В, что отражает слабую тенденцию воды к отдаче е
О2 составляет +0,82 В, что отражает слабую тенденцию воды к отдаче е 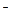 и сильно выраженную способность кислорода к их присоединению. Следует отметить, что в этом интервале находятся редокс-потенциалы многих соединений, принимающих участие в процессах фотосинтеза и дыхания.
и сильно выраженную способность кислорода к их присоединению. Следует отметить, что в этом интервале находятся редокс-потенциалы многих соединений, принимающих участие в процессах фотосинтеза и дыхания.
В мембране тилакоидов и внутренней мембране митохондрий локализованы и определенным образом ориентированы соединения, которые являются переносчиками электронов и имеют разные редокс-потенциалы. Эти соединения, реагируя друг с другом, способны обратимо окисляться и восстанавливаться, поочередно выступая в роли доноров и акцепторов электронов. В результате последовательных окислительно-восстановительных реакций происходит перенос е 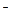 по цепочке от одного переносчика к другому в соответствии со значениями их редокс-потенциалов. Процесс этот называется электронным транспортом, а переносчики электрона формируют электрон-транспортную цепь. Важно знать, что переносчики электрона имеют разную природу, и реакции с их участием могут быть связаны с транспортом непосредственно электрона (е
по цепочке от одного переносчика к другому в соответствии со значениями их редокс-потенциалов. Процесс этот называется электронным транспортом, а переносчики электрона формируют электрон-транспортную цепь. Важно знать, что переносчики электрона имеют разную природу, и реакции с их участием могут быть связаны с транспортом непосредственно электрона (е 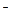 ), атома водорода (Н
), атома водорода (Н 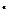 ) или гидрид-иона (
) или гидрид-иона (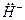 = 2 е
= 2 е 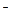 +Н+) от донора к акцептору.
+Н+) от донора к акцептору.
Согласно законам термодинамики, перенос е  в ходе редокс-реакций в ЭТЦ сопровождается изменением свободной энергии G, которое для стандартных условий может быть рассчитано по уравнению
в ходе редокс-реакций в ЭТЦ сопровождается изменением свободной энергии G, которое для стандартных условий может быть рассчитано по уравнению
∆G°' = -nF-∆E°' [Дж ∙ моль-1],
где ∆G°' — стандартное изменение свободной энергии; п — число переносимых электронов; ∆Е°' — разность стандартных потенциалов конечного акцептора и исходного донора е  в реагирующей системе.
в реагирующей системе.
Редокс-потенциалы определены практически для всех участников ЭТЦ дыхания и фотосинтеза. В дыхательной цепи митохондрий электронный транспорт от НАДН на О2 идет по градиенту редокс-потенциала. В процессе фотосинтеза энергия света используется для инициации электронного транспорта от воды к НАДФ+ против градиента редокс-потенциала.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 834; Нарушение авторских прав?; Мы поможем в написании вашей работы!