
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ротационный механизм действия фермента
|
|
|
|
ИЗМЕНЕНИЯМИ АКТИВНЫХ ЦЕНТРОВ АТФ-СИНТАЗЫ.
СИНТЕЗ АТФ СВЯЗАН С КОНФОРМАЦИОННЫМИ
АТФ-синтазы разного происхождения — из митохондрий, хлоропластов или бактериальных мембран — имеют в целом схожее строение, что говорит о, несомненно, древнем эволюционном происхождении фермента. На снимках, полученных при помощи электронной микроскопии, АТФ-синтазы выглядят как локализованные в мембранах грибовидные структуры. Хорошо видно, что фермент состоит из двух частей — двух белковых комплексов, которые обозначают как фактор F1 и фактор Fo (CF1 и CF0 — для АТФ-синтазы хлоропластов). Фактор, или комплекс, F1расположен вне мембраны и на снимках представляет собой «шляпку» гриба высотой 8 нм и шириной 10 нм. Этот гидрофильный сферический комплекс представляет собой каталитический центр, на котором осуществляется синтез АТФ. Гидрофобный F0-фактор интегрально встроен в мембрану и формирует канал, по которому ионы Н+ могут пересекать мембрану, двигаясь по градиенту своего потенциала. Более детально структура фермента была исследована с помощью рентгеноструктурного анализа с разрешением 0,28 нм на комплексах, выделенных из митохондрий сердца быка и мембран Escherichia coli (рис. 2:2).
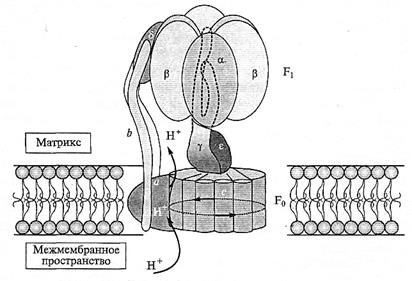
Рис. 2.2. Модель АТФ-синтазы F 1 F 0 -типа.
Периферический F1-фактор состоит из пяти видов субъединиц (α3β3γδε) и несет на (β-субъединицах каталитические центры.
Р1-фактор заякорен в мембране с помощью γ-субъединицы и F0-фактора. F0-комплекс состоит из трех видов субъединиц в соотношении alb2cl0-l2. Субъединицы а и с формируют протонный канал, через который ионы Н+ входят с одной, а выходят с другой стороны мембраны. Движение протонов внутри кольца из с-субъединиц сопровождается его вращением и вращением связанных с ним γε-субъединиц. Ротация сопровождается конформационными изменениями каталитических центров
F1-комплекса, в которых идет синтез АТФ. По-видимому, α3β3-комплекс не вращается, так как удерживается в фиксированном положении с помощью δ- и двух b-субъединиц. В митохондриях F1 -комплекс обращен в матрикс.
Комплекс F1 состоит из пяти разных субъединиц в определенном соотношении: α3β3γδε. Основу его структуры составляют гомологичные субъединицы α и β, чередующиеся друг с другом. Места связывания для нуклеотидов есть на обеих субъединицах, но три активных центра, где происходит синтез АТФ, расположены в основном на субъединицах β. Субъединицы α и β расположены поочередно вокруг γ-субъединицы, которая представляет собой стержень (≈ 9 нм) и, как втулка, проходит через каталитический центр, связывая факторы F1 и Fo. Субъединица δ, расположенная на внешней стороне одной из β-субъединиц, служит сайтом прикрепления двух b -субъединиц, которые заякоривают комплекс F1в мембране. Функции ε-субъединицы связаны с регуляцией: ε-субъединица избирательно препятствует гидролизу АТФ. Фактор F1 легко диссоциирует от Fo и проявляет in vitro АТФазную активность, гидролизуя АТФ.
Комплекс Fo состоит из трех типов белковых субъединиц в следующем соотношении: a1b2с9-12. Он обеспечивает связывание F1 с мембраной и перенос протона. Небольшие, очень гидрофобные
с -субъединицы, имеющие по дватрансмембранных участка, формируют проводящий протоны канал, который обеспечивает прохождение Н+ через всю мембрану. Интересно отметить, что такой сложный ферментный комплекс, как АТФ-синтаза, находится под двойным генетическим контролем: три субъединицы F0-фактора и α-субъединицы фактора F1 кодируются геномом митохондрий или хлоропластов, тогда как синтез остальных субъединиц контролируется ядерными генами.
Исследования АТФ-синтазных комплексов велись давно, но механизм их действия и структурно-функциональная связь факторов F1 и Fo стали понятными относительно недавно. Здесь следует отметить приоритет работ Р.Воуеr и J.Walker (Нобелевская премия, 1997). Благодаря исследованиям этих ученых стал понятным принцип работы фермента, получивший название ротационного механизма. Согласно ротационному механизму, энергия, освобождаемая при диффузии протонов через F0-канал, используется для вращения γ-субъединицы. Результатом ротации γ-субъединицы является последовательная смена конформационных состояний активных центров, расположенных на трех
β-субъединицах Р1-комплекса. Синтез АТФ из АДФ и Фн идет в активных центрах спонтанно благодаря конформационным перестройкам. Энергия Δ  освобождаемая в результате протонного транспорта через F0-канал, используется не на синтез АТФ, а для освобождения АТФ из активного центра в результате изменения его конформации. Прямое доказательство ротационного механизма было получено японскими учеными, которым удалось продемонстрировать вращение γ-субъединицы относительно сидящего на ней фактора F1. Изолированный комплекс F1 был иммобилизован на неподвижной подложке, а к концу γ-субъединицы был химически пришит флуоресцирующий фрагмент нити актина длиной 1 мкм. С помощью флуоресцентного микроскопа в реальном времени удалось наблюдать вращение нити актина при работе фермента, гидролизующего АТФ.
освобождаемая в результате протонного транспорта через F0-канал, используется не на синтез АТФ, а для освобождения АТФ из активного центра в результате изменения его конформации. Прямое доказательство ротационного механизма было получено японскими учеными, которым удалось продемонстрировать вращение γ-субъединицы относительно сидящего на ней фактора F1. Изолированный комплекс F1 был иммобилизован на неподвижной подложке, а к концу γ-субъединицы был химически пришит флуоресцирующий фрагмент нити актина длиной 1 мкм. С помощью флуоресцентного микроскопа в реальном времени удалось наблюдать вращение нити актина при работе фермента, гидролизующего АТФ.
Часто АТФ-синтазу называют молекулярным мотором и используют механические термины для описания ее работы. Считается, что комплекс α3β3-субъединиц удерживается в фиксированном положении, так как за якорем в мембране через субъединицы δ, 2b, а, выполняющие функцию «статора». Ток Н+ вызывает вращение кольца, состоящего из субъединиц с и контактирующих с ним субъединиц γ и ε, которые все вместе выполняют функцию вращающегося «ротора».
Известно, что субъединица а образует 5 трансмембранных α-спиралей и формирует пути для входа Н+ с одной стороны мембраны и выхода — с другой. Движение Н+ внутри кольца из субъединиц с связано с последовательным протонированием/депротонированием ключевого остатка аспартата (Asp-61), расположенного на одной из двух α-спиралей с -субъединиц. Этот процесс сопряжен с поворотом каждой с -субъединицы и запускает пошаговое вращение с-кольца (ротора) относительно ab 2-статора. Расчеты показывают, что синтез одной молекулы АТФ сопряжен с транспортом 3-4Н+ через F0-канал.
Рассмотрим подробно, в результате каких событий происходит синтез АТФ в каталитическом центре фермента. Согласно последним данным (Р. Воуеr, 2002), в результате вращения γ-субъединицы относительно α3β3-комплекса изменяется конформация расположенных на β-субъединицах трех активных центров, каждый из которых в данный момент времени может находиться в трех разных состояниях (рис. 2.3). Эти конформационные состояния, названные «открытым» («open» — О), «закрытым» («tight» — Т) и «слабосвязанным», или «неплотным» («loose» — L), центрами, различаются по степени сродства к АДФ, АТФ и Фн. Принципиальным моментом является тот факт, что в результате тесного контакта между α-, β- и γ-субъединицами конформационные изменения возникают одновременно на всех трех β-субъединицах при повороте γ-субъединицы на 120°. При этом каждый активный центр последовательно проходит через три смены конформаций и возвращается в исходное состояние при полном повороте γ-субъединицы на 360° (см. рис. 2.3). Каталитический цикл начинается со связывания АДФ и Фн в О-центре: в «открытом» состоянии центр имеет высокое сродство к АДФ и крайне низкое — к АТФ. В то же время АДФ и Фн относительно слабо удерживаются в центре и могут выходить из него. Поворот γ-субъединицы на 120° переводит О-центр в «закрытое» Т-состояние. В Т-центре молекулы АДФ и Фн уже прочно связаны и не могут его покинуть. Конформация Т-центра такова, что в нем самопроизвольно идут акты образования и разрыва ковалентной связи АДФ~ФН, т.е. синтеза и гидролиза АТФ.
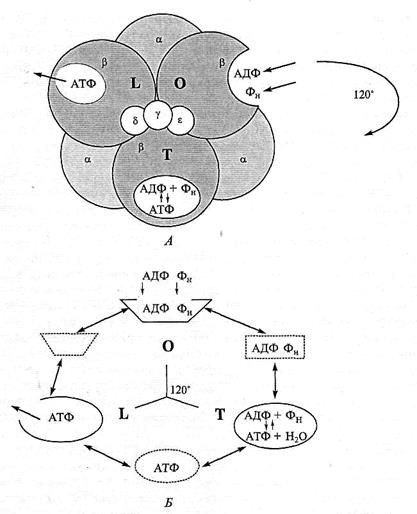
Рис. 2.3. Состояние каталитических центров АТФ-синтазы:
А — F1 - комплекс на трех β-субъединицах несет три активных центра, которые одновременно могут находиться в одном из трех конформационных состояний — О-центр, Т-центр и L-центр. Ротация γ-субъединицы в момент движения протонов через F0-канал вызывает изменение конформации сразу трех центров; Б — конформационные изменения одного активного центра при повороте γ-субъединицы на 360°. Субстраты, АДФ и Фн связываются в «открытом» О-центре. Ротация
γ-субъединицы на 120° переводит центр в «закрытое» Т-состояние. В Т-центре спонтанно идут реакции синтеза и гидролиза АТФ. При следующем шаге вращения на 120° Т-центр переходит в L-центр, из которого возможен выход синтезированной АТФ. Пунктиром указаны возможные промежуточные состояния центров
Важно, что синтез АТФ в «закрытом» центре идет спонтанно, энергетически даром, только за счет создания особой конфигурации между активными группами фермента и молекулами АДФ и Фн. Более того, синтез АТФ в «закрытом» центре может идти даже в условиях деэнергизованной мембраны или даже вне мембраны на изолированном F1- комплексе. Однако освобождения синтезированной АТФ из «закрытого» центра не происходит: для этого необходим следующий этап вращения и переход в состояние L-центра. В этом состоянии связи АТФ с центром ослабевают и молекула может его покинуть и перейти в водную фазу. Следует отметить, что в момент открытия Т-центра в нем находится именно молекула АТФ. Предполагается, что в момент перехода равновесие
АДФ + Фн ↔ АТФ сдвигается в сторону синтеза АТФ под влиянием протондвижущей силы. Следующий этап вращения переводит центр в исходное, «открытое» состояние, из которого, вероятно, также возможен выход АТФ. В течение синтеза АТФ конформационные состояния активных центров последовательно меняются в направлении: О → Т →L → О.
Таким образом, согласно ротационному механизму, энергия Δ  расходуется не на стадии образования химической связи АДФ ~ Фн, а необходима для смены конформаций и выхода АТФ из активных центров фермента. При наличии Ар для быстрого синтеза АТФ в Т-центре второй каталитический центр в О-конформации должен содержать связанные АДФ и фосфат.
расходуется не на стадии образования химической связи АДФ ~ Фн, а необходима для смены конформаций и выхода АТФ из активных центров фермента. При наличии Ар для быстрого синтеза АТФ в Т-центре второй каталитический центр в О-конформации должен содержать связанные АДФ и фосфат.
В условиях, неблагоприятных для синтеза АТФ, например при низком содержании АДФ или Фн или при низкой ∆ρ, возможны гидролиз АТФ и перекачка протонов против градиента. В этом случае происходит связывание АТФ в L-центре и гидролиз АТФ, сопряженный с последовательной сменой конформаций в обратном направлении L → Т →О.
В настоящее время интенсивно изучаются все аспекты работы АТФ-синтазы. Аминокислотные остатки и функциональные группы, критичные для вращения и для конформационных изменений, исследуются с помощью точечного мутагенеза, позволяющего получать мутации, связанные с заменой в структуре фермента одной единственной аминокислоты. В то же время молекулярные механизмы сопряжения двух физически дистанцированных процессов — транспорта протонов и синтеза АТФ — остаются пока неясными.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 2359; Нарушение авторских прав?; Мы поможем в написании вашей работы!