
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые переносчики электронов являются общими для ЭТЦ всех типов
|
|
|
|
Никотинамидадениндинуклеотид (НАД(Н)) и никотинамидадениндинуклеотидфосфат (НАДФ(Н)) — это близкие по структуре растворимые соединения, функциональной частью которых является ароматическое кольцо (рис. 2.4).
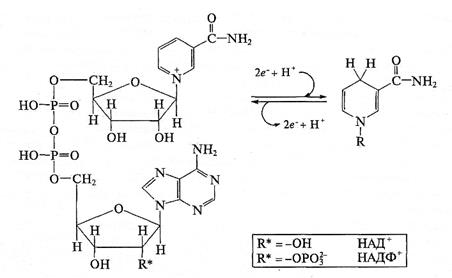
Рис. 2.4. Редокс-превращения в молекулах НАД(Н) и НАДФ(Н).
Окисленные формы НАД+ и НАДФ+ несут положительный заряд на атоме азота
никотинамидного кольца
НАД(Н) и НАДФ(Н) являются коферментами НАД(Ф)-зависимых дегидрогеназ. Эти ферменты катализируют реакции, связанные с отнятием или присоединением двух атомов водорода, при этом коферменты переносят гидрид-ион НТ(2 е 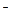 + Н+), а недостающий протон захватывается или отдается в водную фазу:
+ Н+), а недостающий протон захватывается или отдается в водную фазу:
АН2 + НАД(Ф)+ ↔ А+ НАД(Ф)Н + Н+
Большая часть НАД(Н) и НАДФ(Н) растворена в водной фазе, так как их связи с ферментными белками непрочные и возникают только в момент ферментативной реакции. Окисленные формы НАД+ и НАДФ+ имеют полосу поглощения при 260 нм, а при их восстановлении появляется полоса поглощения при 340 нм. Это позволяет регистрировать редокс-состояние коферментов в ходе реакций. Стандартный Е°' этих соединений равен -0,32 В. Роль НАД(Н) и НАДФ(Н) в клетке очень велика. Принимая участие во многих реакциях в качестве доноров или акцепторов электронов, они обеспечивают взаимодействие разных процессов и в целом контролируют редокс-статус клетки.
Флавопротеиды. Компонентами ЭТЦ являются флавопротеиды — белки, содержащие в качестве прочно связанной простетической группы флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Функциональная часть этих соединений представлена системой ароматических колец (рис. 2.5), в состав которой входит остаток рибофлавина (витамин В2). Окисление — восстановление флавопротеидов связано с переносом двух атомов водорода. Окисленные формы флавинов имеют два максимума поглощения — при 375 и 450 нм, которые исчезают при восстановлении. Редокс-потенциалы флавопротеидов варьируют в широких пределах (от -0,49 до +0,19 В) в зависимости от структуры апобелка.
|
| Рис. 2.5. Редокс-превращения в молекулах ФМН и ФАД |
|
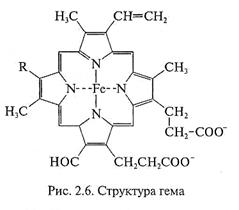
Цитохромы. Обязательными компонентами ЭТЦ являются цитохромы — железосодержащие белки, в составе которых присутствует гем. Основой структуры тема является порфириновое кольцо, образованное из четырех пиррольных ко-
лец, в центре которого расположен атом железа (рис. 2.6). В редокс-превращениях цитохромы функционируют как одноэлектронные переносчики, при этом железо меняет свою валентность, переходя из состояния Fe+2 в состояние Fe+3.
Восстановленные формы цитохромов имеют три характерных полосы поглощения в областях 545 — 600, 520 — 535, 415 — 445 нм — это полосы α, β, γ. На основе положения основного максимума α-полосы цитохромы разделяют на три группы: цитохромы а, b и с. Если цитохромы находятся в окисленном состоянии, то полосы α и β исчезают, а γ-полоса сдвигается в более коротковолновую область. Стандартные Е°' цитохромов варьируют в диапазоне от 0,0 до +0,6 В.
Железосерные белки. Железосерные белки, или Fe-S-белки, содержат так называемые Fe-S-кластеры, или центры. Центры состоят из двух или четырех атомов железа, комплексно связанных с атомами неорганической серы или серы в остатках цистеина в структуре белка. В основе классификации железосерных белков лежит структура кластера; в зависимости от этого различают 2Fe-2S- или 4Ре-48-белки (рис. 2.7).
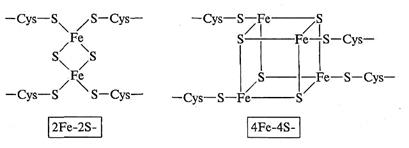
Рис. 2.7. Структура железосерных центров 2Fe-2S- и 4Fe-4S-типа
В состав центра входят несколько атомов железа, но каждый из центров способен принимать или отдавать только один электрон. Восстановление железосерных белков сопровождается исчезновением в спектре полосы 450 нм и появлением сигнала ЭПР (метод электронного парамагнитного резонанса), что указывает на появление свободного радикала. Для этой группы соединений диапазон значений Е°' также достаточно широк: от -0,42 В до +0,35 В.
Хиноны. В качестве подвижных переносчиков, действующих в липидной фазе мембраны, функционируют хиноны, обозначаемые буквой Q (от англ. quinon): пластохинон в ЭТЦ фотосинтеза и убихинон в ЭТЦ дыхания.

Рис. 2.8. Структура (А) и редокс-превращения (Б) в молекуле убихинона
Хиноны состоят из ароматического кольца и боковой липофильной цепи, в составе которой может содержаться 9 (пластохинон) или 10 (убихинон) изопреноидных остатков (рис. 2.8). Свободно диффундирующие в мембране хиноны осуществляют связь между белковыми комплексами и могут переносить два атома водорода. Хиноны обладают двумя свойствами, исключительно важными для работы ЭТЦ по переносу протонов через мембрану. Во-первых, в ходе редокс-реакций хиноны могут захватывать или освобождать 2Н+ на границе раздела двух фаз — липид/вода с любой стороны мембраны. Во-вторых, в ходе электронного транспорта хиноны могут принимать или отдавать только один электрон, при этом находясь в течение какого-то времени в форме свободного анион-радикала — семихинона (Q 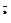 ). Спектры поглощения хинонов находятся в УФ-области и маскируются поглощением других соединений, поэтому их окислительно-восстановительные состояния отслеживают, как правило, методом ЭПР. Редокс-потенциалы хинонов близки к нулю или имеют низкие положительные значения.
). Спектры поглощения хинонов находятся в УФ-области и маскируются поглощением других соединений, поэтому их окислительно-восстановительные состояния отслеживают, как правило, методом ЭПР. Редокс-потенциалы хинонов близки к нулю или имеют низкие положительные значения.
 Итак, живые организмы используют энергию света и химическую энергию органических соединений в процессах фотосинтеза и дыхания. И в том и другом случае клетка превращает внешние энергетические ресурсы в конвертируемые формы клеточной энергии — АТФ и трансмембранный электрохимический протонный градиент Δ
Итак, живые организмы используют энергию света и химическую энергию органических соединений в процессах фотосинтеза и дыхания. И в том и другом случае клетка превращает внешние энергетические ресурсы в конвертируемые формы клеточной энергии — АТФ и трансмембранный электрохимический протонный градиент Δ  . Преобразование энергии в процессах фотосинтеза и дыхания основано на общем механизме хемиосмотического сопряжения.
. Преобразование энергии в процессах фотосинтеза и дыхания основано на общем механизме хемиосмотического сопряжения.
Основной компонент систем трансформации энергии — сопрягающие мембраны хлоропластов и митохондрий, содержащие электронтранспортные цепи. Энергия солнечного излучения или энергия, заключенная в окисляемых субстратах, реализуется таким образом, что в мембране начинает работать электронтранспортная цепь. Электронный транспорт в цепи неразрывно связан с векторным переносом протона через мембрану против электрохимического потенциала. В результате работы цепи энергия внешних источников трансформируется и запасается на мембране в форме Δ 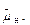 . АТФ-синтазы используют Δ
. АТФ-синтазы используют Δ  , сопрягая обратную диффузию ионов Н+ по градиенту
, сопрягая обратную диффузию ионов Н+ по градиенту
электрохимического потенциала с энергозависимой реакции синтеза АТФ из АДФ и Фн. В соответствии с ротационным механизмом обратный ток протонов через АТФ-синтазный комплекс сопровождается информационными изменениями каталитических центров, в которых спонтанно идет синтез АТФ. Образованная в процессах фотосинтеза и дыхания АТФ обеспечивает энергией разнообразные клеточные процессы, и в том числе используется для энергизации других клеточных мембран при участии АТФаз разных типов. АТФазы, или ионные помпы, эффективно перекачивают некоторые ионы через мембрану против их электрохимического градиента за счет энергии гидролиза АТФ. Создаваемые помпами ионные градиенты на мембранах служат еще одним источником клеточной энергии (рис. 2.9).

Рис. 2.9. Преобразование энергии в растительной клетке
Таким образом, общим принципом клеточной биоэнергетики является взаимопревращение на мембранах двух форм клеточной энергии — энергии ионных градиентов и АТФ. Благодаря этим превращениям клетка обеспечивает энергией разнообразные процессы, протекающие как в растворе, так и на мембранах.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 1195; Нарушение авторских прав?; Мы поможем в написании вашей работы!