
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Трансмембранный электрохимический протонный градиент и его составляющие
|
|
|
|
Состояние вещества s в растворе можно охарактеризовать через химический потенциал μs, который измеряется в единицах свободной энергии. При условии, что активность вещества равна его концентрации и гидростатическим давлением1 можно пренебречь, химический потенциал вещества s равен:
μs =  + 2,3RTlg[Cs] [Дж • моль-1],
+ 2,3RTlg[Cs] [Дж • моль-1],
где 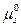 — стандартный химический потенциал вещества s при концентрации 1 М; [Cs] — молярная концентрация вещества s.
— стандартный химический потенциал вещества s при концентрации 1 М; [Cs] — молярная концентрация вещества s.
Состояние иона i определяют через электрохимический потенциал 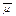 , который учитывает, что
, который учитывает, что
сортояние иона зависит не только от его концентрации, но и от электрического потенциала раствора:
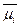 =
= 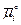 + 2,3RTlg[Ci] + z Fψ[Дж ∙ моль-1],
+ 2,3RTlg[Ci] + z Fψ[Дж ∙ моль-1],
где 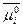 — стандартный электрохимический потенциал при концентрации иона 1 М; R— газовая постоянная (8,314 Дж∙моль-1∙К-1); Т — абсолютная температура, К; [Ci] — концентрация иона в молях; F — число Фарадея (96,49 кДж ∙ В-1 ∙ моль-1); z — заряд иона; ψ — электрический потенциал раствора.
— стандартный электрохимический потенциал при концентрации иона 1 М; R— газовая постоянная (8,314 Дж∙моль-1∙К-1); Т — абсолютная температура, К; [Ci] — концентрация иона в молях; F — число Фарадея (96,49 кДж ∙ В-1 ∙ моль-1); z — заряд иона; ψ — электрический потенциал раствора.
Электрохимический потенциал оценивает свободную энергию иона и учитывает все силы, способные побудить ион к движению из одной области в другую. Спонтанное движение ионов через мембрану из области с более высоким в область с более низким электрохимическим потенциалом представляет собой пассивный транспорт, или диффузию. Движущей силой диффузии является разность электрохимических потенциалов, или трансмембранный электрохимический градиент иона АД,-. Движение иона против градиента электрохимического потенциала требует энергии и называется активным транспортом. Если потенциалы ионов по обе стороны мембраны равны, т. е. ∆ 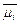 = 0, это означает, что ионные потоки через мембрану находятся в равновесии.
= 0, это означает, что ионные потоки через мембрану находятся в равновесии.
Представим, что мембрана разделяет две области, в которых содержание ионов Н+ разное и
электрохимические потенциалы Н+ соответственно равны:

В результате неравномерного распределения иона Н+ возникает трансмембранный градиент электрохимического потенциала Δ  равный разности электрохимических потенциалов протонов по обе стороны мембраны:
равный разности электрохимических потенциалов протонов по обе стороны мембраны:
 -
-  = Δ
= Δ  = zF∆ψ1-2+ 2,3RTlg[H+]l / [H+]2 [Дж ∙ моль-1],
= zF∆ψ1-2+ 2,3RTlg[H+]l / [H+]2 [Дж ∙ моль-1],
| 1 В гл. 5 «Водный обмен» показано, что химический потенциал воды зависит не только от активности воды, но и от гидростатического давления в системе. |
где Δ  — разность электрохимических потенциалов иона Н+ по обе стороны мембраны; z — заряд иона Н+, равный +1; ∆ψ1-2 - разность электрических потенциалов между двумя водными фазами, разделенными мембраной, т.е. электрический потенциал на мембране в вольтах; [H+]lи [Н+]2 — молярные концентрации ионов Н+ по обе стороны мембраны (индексы 1 и 2 относятся к растворам, находящимся внутри и снаружи замкнутой мембраны).
— разность электрохимических потенциалов иона Н+ по обе стороны мембраны; z — заряд иона Н+, равный +1; ∆ψ1-2 - разность электрических потенциалов между двумя водными фазами, разделенными мембраной, т.е. электрический потенциал на мембране в вольтах; [H+]lи [Н+]2 — молярные концентрации ионов Н+ по обе стороны мембраны (индексы 1 и 2 относятся к растворам, находящимся внутри и снаружи замкнутой мембраны).
Частное от деления величины Δ  на постоянную F называется протондвижущей силой ∆ρ и измеряется в вольтах. Если ввести константы и выразить логарифм концентраций ионов Н+ в единицах рН (рН = -lg [H+]), то для температуры 25 °С получим простое выражение
на постоянную F называется протондвижущей силой ∆ρ и измеряется в вольтах. Если ввести константы и выразить логарифм концентраций ионов Н+ в единицах рН (рН = -lg [H+]), то для температуры 25 °С получим простое выражение
∆ρ = Δ  /F = ∆ψ - 59ΔрН [мВ].
/F = ∆ψ - 59ΔрН [мВ].
Как видно из уравнения, протондвижущая сила состоит из двух компонентов. Первый — это градиент Δ рН, т. е. разность концентраций ионов Н+ по обе стороны мембраны. Градиент рН заставляет ионы Н+ и ОН- концентрироваться около поверхности мембраны. Это приводит к возникновению мембранного потенциала ∆ψ (второй компонент), созданного избытком положительного заряда на одной стороне мембраны и отрицательного — на другой. Эффект мембранного потенциала усиливается другими ионами разных знаков, которые также притягиваются и концентрируются около мембраны. Следует подчеркнуть, что, хотя одна стороны мембраны заряжена более положительно по отношению к другой, основной раствор остается в целом электронейтральным, т.е. содержит равное число катионов и анионов. Дело в том, что число «лишних», несбалансированных ионов, формирующих слой заряда на мембране, ничтожно мало в сравнении с общим числом ионов в растворе.
2.7. ЭНЕРГИЯ Δ  ИСПОЛЬЗУЕТСЯ ДЛЯ СИНТЕЗА АТФ ИЗ АДФ И Фн ПРИ УЧАСТИИ АТФ-СИНТАЗЫ
ИСПОЛЬЗУЕТСЯ ДЛЯ СИНТЕЗА АТФ ИЗ АДФ И Фн ПРИ УЧАСТИИ АТФ-СИНТАЗЫ
Неравномерное распределение протонов по обе стороны мембраны побуждает их к диффузии по градиенту концентрации и заряда, которой препятствует мембрана. Энергия Δ  или ∆ρ является мерой свободной энергии (∆G= Δ
или ∆ρ является мерой свободной энергии (∆G= Δ  ), которая запасена на мембране и может быть освобождена, если протоны начнут проходить мембрану по градиенту своего потенциала. Эта энергия может быть использована, если есть механизм сопряжения диффузии с энергозависимой реакцией. Такой механизм представляет собой АТФ-синтаза (F1F0 — АТФаза, или Н+ АТФаза F-muna), интегрированный в сопря- гающую мембрану ферментный комплекс, который использует энергию Δ
), которая запасена на мембране и может быть освобождена, если протоны начнут проходить мембрану по градиенту своего потенциала. Эта энергия может быть использована, если есть механизм сопряжения диффузии с энергозависимой реакцией. Такой механизм представляет собой АТФ-синтаза (F1F0 — АТФаза, или Н+ АТФаза F-muna), интегрированный в сопря- гающую мембрану ферментный комплекс, который использует энергию Δ  для синтеза АТФ из АДФ и Фн. Синтез сопряжен с обратным током протонов по градиенту своего потенциала через АТФ-синтазный комплекс, т. е. осуществляется в момент разрядки мембраны при уменьшении, или диссипацииΔ
для синтеза АТФ из АДФ и Фн. Синтез сопряжен с обратным током протонов по градиенту своего потенциала через АТФ-синтазный комплекс, т. е. осуществляется в момент разрядки мембраны при уменьшении, или диссипацииΔ  .
.


Обе составляющие ∆ρ — градиент ∆рН и мембранный потенциал ∆ψ — стремятся заставить протоны пересекать мембрану по градиенту концентрации и заряда, и обе составляющие, таким образом, равноценны для синтеза АТФ. Этот тезис подтверждается в экспериментах in vitro. АТФ-синтазы могут быть выделены из мембраны с помощью детергентов и встроены в искусственные мембранные пузырьки (липосомы), приготовленные из очищенных фосфолипидов. В этом случае синтез АТФ можно наблюдать, если искусственно создать градиент рН или приложить к мембране разность электрических потенциалов.
Хотя основная функция АТФ-синтазы — синтез АТФ, этот фермент в определенных условиях может проявлять АТФазную активность, т. е. перекачивать протоны против градиента за счет гидролиза АТФ. Следовательно, АТФ-синтаза (Н+-АТФаза) в принципе способна к взаимопревращению двух форм энергии:

Энергия Δ  может быть использована не только для синтеза АТФ, но и в других целях. Например, в митохондриях она используется для транспорта веществ через мембрану. Кроме того, рассеивание Δ
может быть использована не только для синтеза АТФ, но и в других целях. Например, в митохондриях она используется для транспорта веществ через мембрану. Кроме того, рассеивание Δ  имеет значение в терморегуляторном образовании теплоты (см. гл. 4).
имеет значение в терморегуляторном образовании теплоты (см. гл. 4).
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 2605; Нарушение авторских прав?; Мы поможем в написании вашей работы!