
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Упорядоченность биологических систем и обмен энергией с окружающей средой
|
|
|
|
ЖИВЫЕ ОРГАНИЗМЫ МОГУТ ИСПОЛЬЗОВАТЬ ДВЕ ФОРМЫ ЭНЕРГИИ — СВЕТОВУЮ И ХИМИЧЕСКУЮ
Все живые организмы не могут оставаться живыми и поддерживать высокий уровень организации без постоянного притока энергии извне. При этом они могут использовать только две формы внешней энергии — световую и химическую. Именно по способу получения энергии организмы делят на фото-трофы и хемотрофы. Растения получают энергию в виде электромагнитного излучения Солнца, а животные используют энергию, заключенную в ковалентных связях органических молекул, которые поступают в организм с пищей. Полагают, что первые организмы древней Земли располагали избытком органических соединений, образующихся в ходе геохимических процессов. Они извлекали энергию, окисляя органические соединения в процессах, видимо, сходных с различными видами брожения. Эту способность сохранили клетки всех ныне живущих организмов, способные получать энергию при анаэробном распаде глюкозы в процессе гликолиза. Однако по мере исчерпания запасов органики эволюционное развитие получили фототрофы, использующие энергию света в процессе фотосинтеза и способные синтезировать углеводы из атмосферного СО2 и воды. Фотосинтез сопровождался образованием молекулярного кислорода. Насыщение атмосферы кислородом привело к возникновению и эволюционному доминированию аэробных форм жизни, которые научились получать необходимую им энергию в результате окисления углеводов кислородом в процессе дыхания. Дальнейшая эволюция разделила живых существ на прокариоты и эукариоты, одноклеточные и многоклеточные, на растения и животные, но возникшие на ранних этапах эволюции механизмы использования клеткой энергии остались в своей основе неизменными. При всем разнообразии живых существ и условий среды, в которых они обитают, для получения энергии ими используются три основных процесса — гликолиз, дыхание и фотосинтез. При этом, несмотря на все различия в метаболизме растений, животных и бактерий, способы преобразования внешней энергии, будь то энергия света или энергия субстратов дыхания, в клеточные формы энергии базируются на общих фундаментальных принципах и подчиняются общим законам. Основой этих законов является прежде всего то, что все процессы в живой клетке подчиняются законам физики и химии и могут быть описаны с позиций термодинамики.
Первый закон термодинамики — закон о сохранении энергии, согласно которому энергия не может появляться или исчезать и переходит из одной формы в другую. Живая клетка как раз и представляет собой систему, в которой постоянно происходит преобразование, или трансформация, одних форм энергии в другие, и прежде всего энергии внешних источников во внутренние энергетические ресурсы самой клетки.
Второй закон термодинамики утверждает, что в изолированной системе самопроизвольно могут идти только те процессы, в результате которых степень неупорядоченности, или энтропия1, возрастает, и система переходит из менее вероятного в более вероятное состояние.
В то же время очевидно, что все живые системы организованы сложным образом — множество атомов собраны в чрезвычайно сложные молекулы, а молекулы — в исключительно точные структуры. При этом живая клетка демонстрирует удивительную стабильность и, поддерживая свой внутренний порядок, координирует в пространстве и во времени множество реакций и процессов.
С термодинамической точки зрения поддержание внутренней организации возможно благодаря постоянному поступлению в клетку энергии извне, часть которой выделяется в окружающее пространство в виде тепла. Тепловая энергия усиливает хаотичное движение молекул. Выделяя тепло, клетка тем самым компенсирует внутреннюю упорядоченность, повышая энтропию окружающей среды. Постоянная потеря тепла требует ввода в клетку энергии, отличной от тепловой. Растения используют для этой цели поглощенную световую энергию, а животные — энергию, выделяемую при окислении органических молекул.
2.3. НАПРАВЛЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ ОПРЕДЕЛЯЕТСЯ ВЕЛИЧИНОЙ ∆G
Все реакции, протекающие в клетке, можно разделить на экзергоничесше и эндергонические. Первые идут с выделением энергии, которая может быть рассеяна в виде тепла в окружающую среду. Вторые требуют энергетических затрат и, как правило, способствуют созданию сложной организации и поддержанию внутреннего порядка. Изменение энергии, которое сопровождает химические реакции, можно проанализировать количественно, используя термодинамические параметры: Т — абсолютная температура (К); Р — давление; V — объем; Е — внутренняя полная энергия системы; S — энтропия; Н — энтальпия, или теплосодержание системы; G — свободная энергия системы (энергия Гиббса).
При постоянных Р, Т и V изменение общей энергии системы ∆ Е в результате химической реакции будет равно изменению теплосодержания системы ∆ Н, т. е. тепловому эффекту реакции. В этих условиях термодинамические параметры связаны соотношением:
∆ G = ∆ Н- Т ∆ S.
Для характеристики реакций, которые протекают при постоянных температуре, давлении и объеме, наиболее важным термодинамическим параметром является изменение свободной энергии Гиббса AG. Этот показатель характеризует энергию, которая поглощается или выделяется в ходе реакции или может быть передана другой химической реакции. Для биохимических реакций в растворе при низких концентрациях веществ изменение свободной энергии в результате реакции аА + bВ = сС + dD) можно определить по уравнению:
∆ G = ∆ G° + 2,3RTlg([C]c[D]d /[A]a[B]b) [Дж∙моль-1],
где R — газовая постоянная (8,31 Дж∙ град-1 моль-1); Т — абсолютная температура (К); [А], [В], [С], [D] — молярные концентрации реагирующих веществ; ∆ G° — изменение стандартной свободной энергии данной реакции.
 1 Энтропия — мера неупорядоченности системы; измеряется в специальных энтропийных единицах и выводится как логарифмическая функция вероятности двух состояний.
1 Энтропия — мера неупорядоченности системы; измеряется в специальных энтропийных единицах и выводится как логарифмическая функция вероятности двух состояний.
Величина ∆ G имеет значение стандартной ∆ G °, если реакция протекает при температуре 25 °С и давлении 1 атм, а концентрации субстратов и продуктов реакции одинаковы и равны 1 М. Для биохимических реакций используется показатель ∆ G°', определяемый при рН 7,0.
Для данной реакции ∆ G°' величина постоянная, тогда как ∆ G' зависит от концентрации реагирующих веществ и указывает, насколько данная реакция далека от равновесия. При достижения равновесия ∆ G' = 0, и тогда ∆ G°' можно определить через константу равновесия химической реакции:
∆ G°' = -2,3RTlgK ' РАBH,
где K ' РАBH— константа равновесия химической реакции.
Значения ∆ G°' установлены для большого числа биохимически важных реакций и приводятся в специальной литературе.
Для того чтобы оценить энергетику реакции и предсказать ее направление, важно знать, положительное или отрицательное изменение ∆ G' сопровождает данную реакцию. Если ∆ G' — величина отрицательная, то мы имеем дело с экзергонической реакцией, которая может протекать спонтанно с выделением энергии. Если реакция характеризуется положительным значением ∆ G', то она требует энергетических затрат и самопроизвольно идти не может. Такая эндергоническая реакция возможна только в том случае, если существует механизм, с помощью которого она получит энергию от экзергонической реакции с отрицательным ∆ G' Процесс, в результате которого энергия, выделяемая в ходе экзергонической реакции, не рассеивается в виде тепла, а передается другой реакции, называется энергетическим сопряжением, а сами реакции — сопряженными.
Каким образом происходит сопряжение множества энергодающих и энергозависимых реакций в клетке, где они протекают в разных компартментах и разделены во времени? Для интеграции метаболизма в единое целое вся поступающая в клетку энергия, будь то световая энергия или энергия субстратов дыхания, сначала преобразуется и запасается в форме универсальных энергетических и восстановительных эквивалентов. Универсальными, или конвертируемыми, формами клеточной энергии в растительной1 клетке является трансмембранный градиент электрохимического потенциала
ионов водорода, или электрохимический протонный градиент Δ 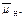 и АТФ. Важнейшими восстанови-
и АТФ. Важнейшими восстанови-
тельными эквивалентами являются никотинамидадениндинуклеотид (НАДН) и никотинамидадениндинуклеотидфосфат (НАДФН). В фотосинтезе поглощение света сопровождается восстановлением НАДФН и синтезом АТФ в хлоропластах. В процессе дыхания, который имеет место в клетках растений и животных, восстановленный НАДН и АТФ образуются в митохондриях. В обоих случаях синтез АТФ опосредован образованием на тилакоидной или митохондриальной мембране электрохимического протонного градиента Δ 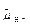 .
.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 1542; Нарушение авторских прав?; Мы поможем в написании вашей работы!