
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия системы. Первое начало термодинамики. Элементарное количество теплоты и работы
|
|
|
|
Внутренней энергией какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Так, например, при определении внутренней энергии некоторой массы газа не должна учитываться энергия движения газа вместе с сосудом и энергия, обусловленная нахождением газа в поле сил земного тяготения.
Следовательно, в понятие внутренней энергии включаются кинетическая энергия хаотического движения молекул, потенциальная энергия взаимодействия между молекулами и внутримолекулярная энергия.
Внутренняя энергия системы тел равна сумме внутренних энергий каждого из тел в отдельности и энергии взаимодействия между телами, представляющей собой энергию межмолекулярного взаимодействия в тонком слое на границе между телами.
Внутренняя энергия является функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, ее внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе системы из одного состояния в другое всегда равно разности значений внутренней энергии в этих состояниях, независимо от пути, по которому совершался переход, т. е. независимо от процесса или совокупности процессов, приводящих к переходу системы из одного состояния в другое.
Внутренняя энергия может изменяться за счет в основном двух различных процессов: совершения над телом работы А' и сообщения ему количества тепла Q.
Совершение работы сопровождается перемещением внешних тел, воздействующих на систему. Так, например, при вдвигании поршня, закрывающего заключенный в сосуде газ, поршень, перемещаясь, совершает над газом работу А'. По третьему закону Ньютона газ при этом совершает над поршнем работу А = – А'.
Сообщение телу тепла не связано с перемещением внешних тел и, следовательно, не ёюб5гсовокупности молекул, из которых состоит тело) работы. В этом случае изменение внутренней энергии обусловлено тем, что отдельные молекулы более нагретого тела совершают работу над отдельными молекулами тела, нагретого меньше. Передача энергии может происходить при этом также через излучение. Совокупность микроскопических (то есть захватывающих не все тело, а отдельные его молекулы) процессов, приводящих к передаче энергии от тела к телу, носит название теплопередачи.
Подобно тому, как количество энергии, переданное одним телом другому, определяется работой A, совершаемой телами друг над другом, количество энергии, переданное от тела к телу путем теплопередачи, определяется количеством тепла Q, отданного одним телом другому. Таким образом, приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы А' и количества сообщенного системе тепла Q:
U2-U1 = Q + A’ (95.1)
Здесь U1 и U2 – начальное и конечное значения внутренней энергии системы. Обычно вместо работы A’, совершаемой внешними телами над системой, рассматривают работу А (равную – А'), совершаемую системой над внешними телами. В этом случае
Q = U2 – U1 + A. (95.2)
Уравнение (95.2) выражает закон сохранения энергии и представляет собой содержание первого закона (начала) термодинамики. Словами его можно выразить следующим образом: количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Сказанное отнюдь не означает, что всегда при сообщении тепла внутренняя энергия системы возрастает. Может случиться, что, несмотря на сообщение системе тепла, ее энергия не растет, а убывает (U2 < U1). В этом случае согласно (95.2) А > Q, т. е. система совершает работу как за счет получаемого тепла Q, так и за счет запаса внутренней энергии, убыль которой равна U1 – U2. Здесь следует вспомнить, что величины Q и A в (95.2) являются алгебраическими, то есть могут обладать разными знаками.
При вычислении совершенной системой работы или полученного системой тепла обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому (в пределе – бесконечно малому) изменению параметров системы. Уравнение (95.2) для элементарного процесса имеет вид
D'Q = DU + D'A, (95.3)
где D'Q– элементарное количество тепла, D'А– элементарная работа и DU– приращение внутренней энергии системы в ходе данного элементарного процесса.
Весьма важно, что D'Q и D'A нельзя рассматривать как приращения величин Q и А. Соответствующее элементарному процессу изменение D какой-либо величины f (Df) можно рассматривать как приращение этой величины только в том случае, если SDf, соответствующая переходу из одного состояния в другое, не зависит от пути, по которому совершается переход, т. е. если величина f является функцией состояния. В отношении функции состояния можно говорить об ее «запасе» в каждом из состояний. Например, можно говорить о запасе внутренней энергии, которым обладает система в различных состояниях.
Вообще говоря, величина совершенной системой работы и количество полученного системой тепла зависят от пути перехода системы из одного состояния в другое. Следовательно, ни Q, ни А не являются функциями состояния, в силу чего нельзя говорить о запасе тепла или работы, которым обладает система в различных состояниях.
Таким образом, в символ D, стоящий при А и Q, вкладывается иной смысл, чем в символ D, стоящий при U. Чтобы подчеркнуть это обстоятельство, в первом случае D снабжено штрихом. Символ DU означает приращение внутренней энергии, символы D'Q и D'А означают не приращение, а элементарное количество теплоты и работы.
Это обстоятельство не меняет формальную сторону дела. Например, чтобы произвести вычисления, в (95.3) переходят к дифференциалам. Тогда уравнение первого начала принимает следующий вид:
d'Q = dU + d'A. (95.4)
Интегрирование (95.4) по всему процессу приводит к выражению Q = U2 – U1 + A, тождественному уравнению (95.2).
В то же время, результат интегрирования d'A нельзя записать в виде 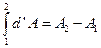 . Такая запись означала бы, что совершенная системой работа равна разности значений (т. е. запасов) работы во втором и первом состояниях.
. Такая запись означала бы, что совершенная системой работа равна разности значений (т. е. запасов) работы во втором и первом состояниях.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!